Выращивание березы повислой (Betula pendula Roth) in vitro
Конференция: CXXV Студенческая международная научно-практическая конференция «Молодежный научный форум»
Секция: Сельскохозяйственные науки

CXXV Студенческая международная научно-практическая конференция «Молодежный научный форум»
Выращивание березы повислой (Betula pendula Roth) in vitro
Введение. В последние десятилетия на одинаковом уровне с классическими методами воспроизведения древесных растений масштабно используют методы биотехнологии, в особенности микроклональное размножение- это техника in vitro для получения неполовым путём растений, идентичных исходному в асептических условиях на синтетических питательных средах, в кратчайшие сроки [1, с. 17].
Представители рода Betula (береза), широко распространенные, особенно в северных частях Евразии и Северной Америки, являются одними из важнейших лиственных пород деревьев в этих регионах [4, с. 77].
Традиционно березы размножаются семенами или вегетативными саженцами. На ранней стадии роста всходы растут намного быстрее, поэтому 4-5-летние всходы выше, чем вегетативные [3, с. 38].
Исследования базируются на опыте сотрудников лаборатории in vitro ЦКП ЭБЭЭ ПГТУ по микроразмножению растений.
Цель настоящей работы — изучить и оценить перспективы роста березы повислой в питательных средах с различными концентрациями БАП (6-бензиламинопурин).
Материалы и методы. В качестве исходного растительного материала служили семена березы (Betula pendula Roth). Семена были собраны со взрослых деревьев березы, произрастающих в дендропарке в ботаническом саду ПГТУ в 2019 году. Собранные семена, в течение двух недель, охлаждали при 4 ° C в поликарбонатных пробирках Де Вит. Через 2 недели, после охлаждения у семян удалялись семенные крылья и их оставляли на 24 ч. под проточной водой. Их следует продезинфицировать в 0,3-ом % растворе фунгицида Медян Экстра в течение 10 минут, после стерилизации семена промывают дистиллированной водой [2, с. 105]. Далее в течение 3 минут выдерживают 72-х % в спирте и вновь промывают несколько раз дистиллированной водой. В завершении их помещали в 20-ти % раствор биоцида Саносил С на 20 минут и трижды промывали дистиллированной водой [2, с. 105]. Стерилизованные семена помещали в стерильные пластиковые конверты и хранили в холодильнике при 2 ° С в течение 3 суток. Замороженные семена повторно стерилизовали в 1-ом % растворе нитрата серебра, несколько раз промывали дистиллированной водой и помещали в 30-ый % раствор отбеливателя ACE и затем промывали стерильной дистиллированной водой в течении 5-ти минут. После семена помещали на стерильную фильтровальную бумагу и давали им полностью просохнуть под потоком воздуха в ламинарном боксе, далее их переносили в стерильные чашки Петри, в которых находилась стерильная затвердевшую питательную среду МС без регулятора роста.
Пророщенные семена (проростки) из культуральной среды МС без регулятора роста переносили в культуральную среду МС с различными концентрациями цитокинина БАП в колбы Эрленмейера объёмом 100 мл с содержанием 25 мл стерильной среды согласно схеме испытаний, указанной в таблице 1.
Таблица 1.
Схема концентраций БАП в питательной среде (6-бензиламинопурин)
|
№ колбы |
1 |
2 |
3 |
4 |
5 |
6 |
|
Концентрация БАП, мг/л |
0,0 (контроль) |
0,1 |
0,5 |
1,0 |
2,0 |
5,0 |
Исследование проводили в трех повторностях, в одну колбу помещали по 10-13 проросших семян или проростков. Измерения и оценка состояния растений проводилась на 6-ой и 10-ой неделе эксперимента. Условия выращивания: стерильную культуру выращивали в культуральной комнате при температуре 25 ° C, интенсивности света 50 мкмоль/м²с и световом периоде 16/8 ч (день / ночь).
Результаты и обсуждения. В наших опытах через 6 недель роста проростки березы повислой, были наивысшими на среде МС без регуляторов роста (контрольный вариант) - 2,20 см. При наличии в питательной среде различных концентраций БАП (0,1–5,0 мг/л) высота проростков составляла 0,27–1,5 см. Как видно из представленных данных (рис.1.), высота проростков снижалась равномерно с увеличением количества цитокинина БАП в питательной среде. 5,0 мг/л БАП оказали особенно ингибирующее действие на рост проростков in vitro, со снижением высоты проростков на 1,93 см или 87,7% по сравнению с контролем. Действие цитокинина БАП 0,5 и 1,0 мг/л было сходным - проростки были на 1,3-1,4 см ниже по сравнению с контрольным вариантом (среда МС без БАП).
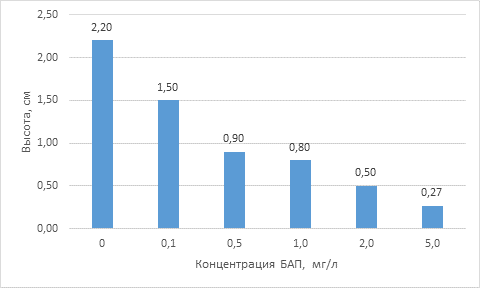
Рисунок 1. Влияние БАП на высоту проростков (через 6 недель)
После второго субкультивирования (через 10 недель после помещения на питательную среду) проростки березы повислой, показали наибольший рост на среде MS без регуляторов роста (контроль) - 2,4 см. Из представленных данных видно, что при увеличении концентрации цитокинина БАП в культуральной среде (1,0–5,0 мг / л) рост проростков подавлялся (рис. 2). Концентрация 0,5 мг/л БАП оказывала наибольшее ингибирующее действие на высоту проростков, по сравнению с контрольным вариантом, проростки были на 2,18 см или на 88,75% ниже. Наименьший ингибирующий эффект на рост проростков был 0,1 мг/л БАП - проростки были ниже всего на 18,75%.
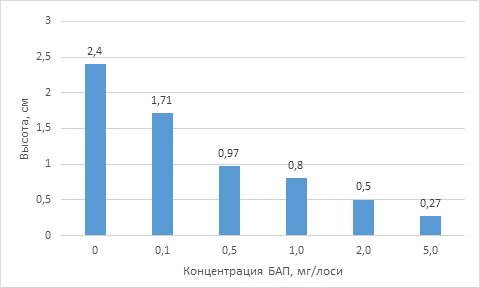
Рисунок 2. Влияние БАП на высоту проростков (через 10 недель)
Через шесть недель так же отмечалось, что у самых высоких проростков длинна корней на среде МС без регуляторов роста (контроль) составляла - 3,5 см. По мере увеличения концентрации БАП в среде корни укорачивались, и 0,1–1,0 мг/л БАП оказывали аналогичное влияние на рост корней. Вследствие ингибирующего действия 5,0 мг / л проростки не образовывали корней.
У проростков, растущих на среде с добавлением 0,1 мг/л БАП, было наибольшее количество корней после второго субкультивирования (через 10 недель после помещения в среду, содержащую БАП). У проростков контрольного варианта было на 40,5% меньше корней, чем в ростовой среде с 0,1 мг/л БАП. Наибольший ингибирующий эффект на корни составил 5,0 мг/л БАП, эффект 1,0-2,0 мг/л БАП был одинаковым.
После 10 недель роста на среде MS у проростков березы повислой были корни длиной 0,74-5,2 см. Самые длинные корни росли на среде с содержанием 0,1 мг/л БАП (5,2 см). Корни контрольного варианта были на 0,9 см короче, чем на среде с минимальной концентрацией (0,1 мг / л) исследуемого БАП.
Вывод. После первой субкультуры БАП подавляет рост проростков березы повислой in vitro, после второй субкультуры концентрация 0,1 мг/л БАП является наиболее подходящей для корневого развития, а среда подходит для роста проростков.
Эффектом воздействия 1,0 мг/л БАП стало образование каллуса в интерстициальных тканях, а результатом воздействия 2,0 мг/л БАП и 5,0 мг/л БАП, стало образование дополнительных листьев.
Тестируемые концентрации БАП оказывали видимое ингибирующее действие на количество проростков березы повислой. В питательной среде МС с самой высокой концентрацией (5,0 мг/ л) БАП у проростков не образовывала корней. У проростков, выращенных в контрольном варианте (среда МС без цитокинина) в течение шести недель, в среднем по 2 корня. Концентрация 0,1–2,0 мг/л БАП увеличивала количество корней вдвое.





