Метод выщелачивания золота в цианистом растворе в присутствии альтернативных окислителей
Секция: Технические науки

XLI Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: технические и математические науки»
Метод выщелачивания золота в цианистом растворе в присутствии альтернативных окислителей
В настоящее время цианирование остается основным методом добычи золота и серебра из руд.
Преимуществами процесса цианирования является его селективность по отношению к золоту, серебру и другим благородным металлам, сравнительно небольшие расходы цианидов (0,2–0,5 кг/т руды), нахождение золота и серебра в виде анионных комплексов, легко отделяемых от катионных примесей на ионообменных сорбентах. Основным недостатком данной технологии является низкая скорость выщелачивания золота [1].
Реакция золота с цианидами протекает в присутствии кислорода воздуха: измельчённую золотоносную породу обрабатывают разбавленным раствором цианида натрия, из образующегося раствора цианоаурата натрия Na[Au(CN)2] золото осаждают либо цинковой пылью, либо на специальных ионообменых смолах.
Для золота химизм процесса описывается уравнением:
4Au + 8NaCN + 2H2O + O2= 4Na[Au(CN)2] + 4NaOH (1)
Серебро растворяется по реакции:
4Ag + 8NaCN + O2 + 2H2O = 4Na[Ag(CN)2] + 4NaOH (2)
Повышение концентрации кислорода интенсифицирует процесс.
Кислород – малорастворимый в воде газ. Его концентрация в воде при нормальных условиях не превышает 8 мг/л. Если учесть, что при растворении золота кислород непрерывно расходуется, то обычная его концентрация в прилегающем к поверхности золотин слое, оказывается неизмеримо ниже и в среднем составляет не более 2–3 мг/л. Для обеспечения высокой скорости растворения золота такой концентрации кислорода совершенно недостаточно. Поэтому, чтобы интенсифицировать процесс растворения золота, нужно подать в зону реакции не только достаточное, но и избыточное количество кислорода. Опыты показали, что отсутствие кислорода в растворе совершенно прекращает растворение металла даже при наличии достаточной концентрации цианида. Увеличение концентрации кислорода в растворе можно добиться путем введения альтернативных окислителей [2].
Целевое назначение кислорода и альтернативных окислителей – акцептировать электроны, донором которых является окисляемое золото.
4Au + 8NaCN + 2Н2О2 = 4Na [Au(CN)2] + 4NaOH (3)
Чем активнее окислитель, чем выше его окисляющая способность и концентрация в выщелачивающем растворе, тем большей скорости окисления следует ожидать. Вместе с тем, при достаточном окислительном потенциале, например в присутствии перекиси водорода, помимо золота, может окисляться и цианид:
NaCN+H2O2=NaCNO+H2O. (4)
Приведенная реакция является химической основой широко используемого метода обезвреживания сбросных цианистых растворов [3].
Таким образом, само по себе введение более сильного, чем кислород, окислителя, являясь основой ускорения цианистого выщелачивания, имеет ограничение. Вполне очевидно, что ограничивающим фактором является окислительно-восстановительный потенциал (ОВП) выщелачивающей системы. Этот параметр должен обеспечивать интенсификацию окисления золота (реакция 3), но быть меньше значения, при котором становится возможным окислительное разложение цианида (реакция 4).
Окислительные потенциалы известных окислителей и их предельные концентрации различны. В практическом применении критерием является значение ОВП, являющееся производным от значения стандартного ОВП окислителя и его концентрации в выщелачивающей системе. Значения стандартных значений ОВП полурекций окисления золота и циан-иона, а также ОВП, характеризующие окислительный потенциал кислорода, перекиси, бромат-иона, озона приведены в таблице 1.
Таблица 1.
Значения стандартных ОВП возможных превращений при цианистом выщелачивании
|
№ |
Реакция |
Е0, В |
|
1 |
Au+2CN-=Au(CN)2- + ē |
-0.54 |
|
2 |
CN-+ 2OH-= CNO- + H2O + 2ē |
-0.97 |
|
3 |
O2(г) +2H2O +4 ē = 4OH- |
+ 0.4 |
|
4 |
BrO3- + 2H2O + 4 ē = Br- + 4OH- |
+0,54 |
|
5 |
BaO2+ 2H + 2ē = BaO + H2O |
+1,02 |
|
6 |
H2O2 +2ē = 2ОН- |
+ 0,95 |
|
7 |
O3 (г) +H2O+ 2ē= O2(г) + 2ОН- |
+ 1,24 |
Из приведенных данных следует, что:
· термодинамически в цианистом растворе золото окислить легче, чем циан-ион;
· кислород по значению ОВП значительно уступает альтернативным окислителям.
Специальные исследования показали, что независимо от вида используемого окислителя, но при разных концентрациях, окислительное разложение цианида наблюдается при достижении ОВП -0,3 ÷ -0,5 В. Очевидно, что при цианировании концентрация альтернативного окислителя должна быть меньше, чем та, при которой достигается данный ОВП.
При выборе альтернативного окислителя предпочтение следует отдавать перекиси водорода, как наиболее доступному и экологически нейтральному реагенту. Опыты показали, что при замене кислорода на перекись при прочих равных условиях наблюдается ускорение растворения золота в 1,5–2 раза. Заметное окисление цианида начинается при концентрации перекиси 3–5 г/л; что соответствует значению ОВП-0,4В.
Повышенная до допустимого уровня концентрация окислителя предоставляет возможности дополнительно ускорить процесс выщелачивания с использованием более концентрированных по цианиду растворов. Исследованиями установлено, что в растворах с концентрацией NaCN от 1 до 10 г/л при использовании разных окислителей скорость выщелачивания золота возрастает еще в 1,3–1,5 раза. Использование более высоких концентраций цианида положительного эффекта не оказывает.
При использовании альтернативного окислителя для ускорения процесса становится возможным использовать еще один технологический фактор – нагрев пульпы. В соответствии с известными физико-химическими законами скорость большинства химических превращений резко возрастает при повышении температуры. Целевые опыты подтвердили, что при прочих равных условиях цианистое выщелачивание золота и, особенно, серебра при нагревании с 20 до 50°С протекает в 2–3 раза интенсивнее. Чрезмерное повышение температуры технологически неприемлемо и экономически неоправданно. При температуре выше 60°С наблюдается интенсивное испарение растворов и усиливается нежелательная реакция разложения цианида [4]. Целью исследований была проверка влияния добавки окислителей на интенсификацию процесса цианистого выщелачивания золота. Также проведена оценка влияния температуры в совокупности с действием окислителей.
Обсуждение результатов
Исследования проводили на золотом диске диаметром 13мм. В качестве альтернативных окислителей были выбраны: KBrO3, 40%-й раствор H2O2, 3%-й раствор H2O2.
Результаты опытов представлены в таблице 2и на рисунках 1 и 2.
Таблица 2.
Результаты опытов на золотом диске
|
Активатор |
Концентрация Au в растворе, мг/л |
|
|
Без нагрева |
С нагревом |
|
|
Без активатора |
9,17 |
33,4 |
|
Добавка H2O2 40% 2 г/л |
14,77 |
49,22 |
|
Добавка H2O2 3% 2 г/л |
15,19 |
51,3 |
|
Добавка KBrO3 2 г/л |
12,36 |
46,8 |

Рисунок 1. Концентрация золота в растворе с применением активаторов
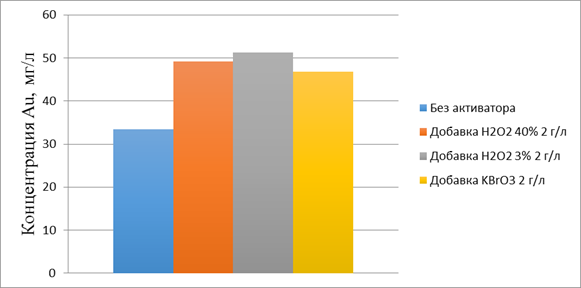
Рисунок 2. Концентрация золота в растворе с применением активаторов и нагревом
В данной работе применялись растворы перекиси с разной концентрацией. Это связано с тем что в 3%-й перекиси содержится бензоат натрия, который препятствует разложению цианида. На практике лучшим окислителем является 40%-й раствор перекиси. Он обеспечивает приемлемые показатели извлечения золота, а также потребуются меньшие затраты на транспортировку раствора.
По результатам проведенных опытов можно сделать вывод, что применение дополнительных реагентов-окислителей дает положительный эффект, скорость цианирования возрастает. Подогрев раствора также оказывает положительное действие. Данные реагенты относительно недорогие, не агрессивны к аппаратуре и не токсичны. Применение их в процессе цианирования позволит получить дополнительную выгоду.





