Способы генерации подъемного газа (водорода) в летательных аппаратах легче воздуха во время полета
Секция: Технические науки

III Студенческая международная научно-практическая конференция «Технические и математические науки. Студенческий научный форум»
Способы генерации подъемного газа (водорода) в летательных аппаратах легче воздуха во время полета
Вопрос необходимости генерации подъемного газа во время длительного пребывания в воздухе летательного аппарата легче воздуха (ЛАЛВ) напрямую определяет максимальное время полета ЛАЛВ. Время полета, в свою очередь, определяет степень автономного функционирования ЛАЛВ, круг решаемых задач ЛАЛВ и эффективность их выполнения (также функционирование ЛАЛВ определяется и временем работы аппаратуры). Любой газ, а особенно газы с малой молекулярной массой, обладают высокой диффундирующей способностью через композитные материи оболочек. В данной статье в качестве подъемного газа рассматривается водород как идеальный газ.
Объем выделяемого водорода для компенсации потерь для разных ЛАЛВ разный. В основном определяется объемом оболочки и временем автономного нахождения в полете. На ЛАЛВ, использующих в качестве подъемного газа водород, по умолчанию в конструкции предусмотрена максимальная степень защиты от воспламенения водорода в смеси с воздухом.
Существует несколько способов получения водорода (не рассматриваются процессы, где водород является побочным продуктом, например, при производстве хлора):
В промышленности:
2. Газификация угля;
3. Глубокое охлаждение водяного газа;
4. Электролиз водных растворов солей, оснований и кислот;
5. Термическое разложение углеводородов;
Лабораторные методы:
6. Гидролиз и термическое разложение гидридов активных металлов;
7. Реакция воды с активными металлами;
8. Биотехнологии.
Рассмотрим эффективность способов получения водорода с точки зрения технических условий на водород для ЛАЛВ и требований к способам получения водорода [1, с. 71; 72].
Технические условия на водород для ЛАЛВ.
Частота водорода ≥ 98%. В составе 2% примесей допускаются:
Азот - ![]()
Кислород - ![]()
Углекислый газ - ![]()
Окись углерода - ![]()
Метан - ![]()
Влага (не входит в состав этих 2%)
Нежелательны:
Тяжелые углеводороды - ![]() ,
, ![]() ,
, ![]()
Не допускаются:
Мышьяковистый водород - ![]()
Фосфористый водород - ![]()
Хлор - ![]()
Сероводород - ![]()
Сероуглерод - ![]()
Сернистый газ - ![]()
Требования к способам получения водорода.
При выборе способа получения водорода и газовой установки, необходимо оценить их с точки зрения:
1. Производительности;
2. Концентрации получаемого водорода;
3. Примесей, вредных для материалов аэростатных оболочек и ядовитых для обслуживающего персонала (если есть);
4. Минимальных энергетических затрат получения водорода (электричество);
5. Простоты газовой установки по устройству (также обслуживанию и ремонту при нахождении человека на борту ЛАЛВ) и минимальной ее массы;
6. Автоматизации процесса;
7. Готовности установки к быстрому пуску и прекращению процесса;
8. Безопасности работы установки в отношении взрывов и причинения иных повреждений ЛАЛВ и персоналу (если есть);
9. Безвредность для окружающей среды побочных продуктов при образовании водорода, возможности их повторного использования на ЛАЛВ и минимальной их массы;
10. Доступности, дешевизны и малого веса исходного сырья для получения 1 м3 водорода.
Оценить на данный момент способы получения водорода по пунктам 5, 6, 7, 8 текущих требований к способам получения водорода не представляется возможным, т.к это уже конструкторские задачи. В данной статье не рассмотрены способы получения водорода из чрезмерно агрессивных к конструкционным материалам и ядовитых веществ (например, бороводородов).
Конверсионный метод, газификация угля и глубокое охлаждение водяного газа.
Рассмотрим паровую и парокислородную конверсию метана. Паровая конверсия:
![]()
![]()
парокислородная конверсия:
![]()
Частота получаемого водорода при паровой конверсии около 75,5%, парокислородной - 71,5%. Для дальнейшего использования на ЛАЛВ водород необходимо очистить, что требует наличия дополнительных установок на борту. Паровая конверсия проходит при температуре 750-850 ºС и давлении 2,0 - 2,5 МПа, парокислородная - при температуре 1200-1500 ºС, т.е являются энергозатратными. Так же установки для такого способа получения водорода имеют большие габариты и массу, что делает их не пригодным для автономного использования на ЛАЛВ. Хотя и имеют большой выход водорода - на 1 м3 метана и 268 г воды получается 3 м3 и низкую стоимость исходного сырья. Получение водорода при помощи газификации угля и глубоким охлаждением водяного газа так же как и метод конверсии непригодны для использования на ЛАЛВ в силу тех же причин.
Электролиз водных растворов солей, оснований и кислот.
При пропускании электрического тока через растворы кислородосодержащих кислот и оснований, а так же солей активных металлов, находящимися в ряду напряжения металлов, левее алюминия, практически происходит электролиз воды. При этом на катоде выделяется водород, а на аноде кислород [2]:
![]()
При электролизе растворов кислородосодержащих кислот восстанавливаются катионы Н+:
![]() ;
;
Катионы активных металлов от Li до AL включительно (рис. 1) не восстанавливаются, а восстанавливаются молекулы воды:
![]()
![]()
Рис.1 Ряд активности металлов
Выделяющийся при этом водород имеет высокую частоту (конструкцией электролита можно добиться частоты ≥ 99,98%). Электролиты, содержащие Ba и металлы после Mn рассматривать не будем, т.к электролиты имеют большую массу на единицу объема выделяющегося водорода, по сравнению с другими активными металлами. Так же не рассмотрены активные металлы Rb (рубидий) и Sr (стронций), по той же причине что и барий, к тому же металлы достаточно редкие и дорогие.
По второму закону Фарадея объем выделяющегося водорода при электролизе:
![]()
![]()
определим величину заряда, необходимую для выделения ![]() :
:
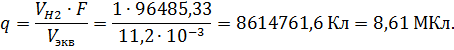
Потребное напряжение источника тока для электролиза будет меньше, чем больше удельная электропроводность электролита. Удельная электропроводность электролита в свою очередь зависит от концентрации электролита и температуры раствора [3]. Например, удельная электропроводность 10% раствора гидроксида натрия (NaOH) и температуре 18ºС около 31,3 Ом-1∙м-1, а серной кислоты (Н2SO4) при тех же условиях около 40 Ом-1∙м-1. При таких условиях выбора серная кислота предпочтительнее.
Гидролиз и термическое разложение гидридов активных металлов .
В процессе гидролиза выделяется чистый водород. Рассмотрим гидриды металлов Li, Na, K, Be, Mg, Ca, Al. Оценим производительность реакций из отношения массы первоначальных продуктов к единице объема получаемого водорода. Все исходные гидриды - LiH, NaH, KH, BeH2, MgH2, CaH2, AlH3. Рассмотрим расчет на примере гидрида лития:
![]()
7,949 г/моль гидрида лития даст 22,4 л/моль водорода, откуда для получения 1 м3 водорода потребуется гидрида лития
![]()
и воды
![]()
суммарная масса веществ до реакции
![]()
Посчитаем так для всех гидридов (при н.у) и сведем результаты в таблицу.
Таблица 1
Массы веществ до гидролиза для получения 1 м3 водорода
+Н2О |
LiH |
NaH |
KH |
BeH2 |
MgH2 |
CaH2 |
AlH3 |
Гидрид, кг |
0,355 |
1,086 |
1,79 |
0,246 |
0,588 |
0,94 |
0,433 |
Вода, кг |
0,804 |
0,804 |
0,804 |
0,804 |
0,804 |
0,804 |
0,804 |
m∑, кг |
1,159 |
1,89 |
2,594 |
1,05 |
1,392 |
1,744 |
1,237 |
Видно, что воды требуется одинаковое количество для всех реакций. Воду на борту ЛАЛВ можно получать из воздуха или изначально иметь запас воды на борту. Например, на высотах до 2 км где ещё температура воздуха положительна воду можно получить при помощи осушителей, на высотах более 2 км где уже наблюдается отрицательная температура, потребуется иное устройство для сбора уже кристаллов льда. Это дополнительный вес к ЛАЛВ.
Все гидриды активно реагируют с водой с выделением тепла и могут самовоспламеняться на воздухе, для возможности использования их на ЛАЛВ требуются повышенные меры безопасности, предусмотренные конструкцией и автоматикой управления процессом.
В процессе термического разложения гидридов активных металлов так же выделяется чистый водород. Рассмотрим термическое разложение элементов в вакууме. Например, термическое разложение гидрида калия:
![]()
80,22 г/моль гидрида калия даст 22,4 л/моль водорода, откуда для получения 1 м3 водорода потребуется гидрида калия
![]()
Посчитаем так для всех гидридов (при н.у) и сведем результаты в таблицу.
Таблица 2
Массы веществ до термического разложения для получения 1 м3 водорода
|
LiH |
NaH |
KH |
BeH2 |
MgH2 |
CaH2 |
AlH3 |
Гидрид, кг |
0,71 |
2,143 |
3,581 |
0,492 |
1,175 |
1,879 |
0,867 |
Температура разложения ≈, ºС [4] |
850 |
400 |
400 |
125 |
280 |
1000 |
105 |
Для термического разложения требуется большая масса гидридов, чем при гидролизе. К тому же необходимо создать вакуум и подводить энергию. В этом отношении гидролиз гидридов предпочтительнее. Достоинство данного метода заключается в возможности получения водорода на больших высотах, где сбор влаги из воздуха затруднителен, а эффективность солнечных батарей (если таковые имеются на борту) высокая для питания устройств для термического разложения.
Грузоподъемность выделяющегося объема водорода (1 м3) при нормальных условиях равна около 1,14 кг (с увеличением высоты грузоподъемность водорода падает из-за уменьшения плотности воздуха). Лишь в случае гидролиза гидрида бериллия (BeH2) грузоподъемность водорода больше чем масса веществ до реакции или примерно равна при гидролизе гидрида лития (LiH). В случае термического разложения, имеет смысл использовать BeH2 и AlH3. В плане же экономичности и доступности предпочтителен AlH3.
Реакция воды с активными металлами.
Все щелочные и щелочноземельные металлы (кроме бериллия и магния) реагируют при нормальных условиях с водой с образованием чистого водорода. Например, реакция Al (при удаленной защитной оксидной пленки) с водой:
![]()
52,184 0,777 г/моль Al даст 67,2 л/моль водорода, откуда для получения 1 м3 водорода потребуется Al
![]()
и воды
![]()
суммарная масса веществ до реакции
![]()
Посчитаем так для всех активных металлов (при н.у) и сведем результаты в таблицу.
Таблица 3
Массы веществ до реакции для получения 1 м3 водорода
+Н2О |
Li |
Na |
K |
Ca |
Al |
Гидрид, кг |
0,62 |
2,053 |
1,746 |
1,789 |
0,777 |
Вода, кг |
0,804 |
1,608 |
1,608 |
0,804 |
1,608 |
m∑, кг |
1,424 |
3,661 |
3,354 |
2,593 |
2,385 |
Наиболее выгодны реакции с водой лития и алюминия. Для хранения металлов на борту ЛАЛВ необходимо обеспечить дополнительные условия (например, литий хранят в керосине).
Термическое разложение углеводородов.
Рассмотрим термическое разложение метана:
![]()
Для получения 1 м3 водорода необходимо 0,5 м3 метана. Практически такой процесс осуществляют, сжигая метан при недостатке кислорода. Метан может использоваться на борту ЛАЛВ как топливо для двигателей и как газ легче воздуха, составляющий статическую подъемную силу аппарата. Плотность метана при н.у 0,717 кг/м3, а воздуха 1,29 кг/м3. Взрывоопасная концентрация метана в воздухе от 4,4% до 17%, наиболее опасная концентрация 9,5% [5], что обязывает использовать в ЛАЛВ дополнительные меры по безопасности. Имея достаточный запас метана на борту и правильно организованный процесс термического разложения, можно безопасно получать водород высокой частоты.
Производство водорода происходит с участием микробиологических систем (бактерий и водорослей или с помощью субклеточных частиц этих организмов) в биореакторе. В биореакторе происходит биофотолиз воды, т.е разложение воды на кислород и водород. Производительность, масса биореактора и многие другие параметры не известны, оценить возможность применения такого метода на ЛАЛВ пока не представляется возможным.
Для более детального анализа способов получения водорода необходимо провести множество расчетов, серий экспериментов и выявить множество зависимостей. Так же существенную роль играет конструкция генератора водорода под тот или иной способ получения водорода и конструкция всего ЛАЛВ в целом.
Список литературы:
1. Когутов И. - Газовое дело в дирижаблестроении. М.: Редакционно-издательский отдел Аэрофлота, 1938. 71 с;
2. Электролиз расплавов и растворов. - [Электронный ресурс] - Режим доступа. - URL: https://sites.google.com/site/himulacom/zvonok-na-urok/11-klass---cetveertyj-god-obucenia/elektroliz
3. Удельная и эквивалентная электропроводность. Зависимость от концентрации электролита. - [Электронный ресурс] - Режим доступа. - URL: https://studopedia.su/7_21887_udelnaya-i-ekvivalentnaya-elektroprovodnost-zavisimost-ot-kontsentratsii-elektrolita.html
4. Гаврюченкова Ф.Г. - Химия. Справочное руководство. Изд. "Химия" Ленинградское отделение, 1975.
5. ГОСТ Р 52350.29.1-2010 - Национальный стандарт РФ. Взрывоопасные среды, часть 29-1





