Распад гидропероксида изопропилбензола, катализированный дибензо-18-краун-6 эфиром
Секция: Химия
лауреатов
участников
лауреатов


участников



XLI Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
Распад гидропероксида изопропилбензола, катализированный дибензо-18-краун-6 эфиром
В настоящее время продолжаются исследования в области окислительного катализа и синтеза различных кислородсодержащих продуктов, так как последние являются важными продуктами основного органического синтеза. Основой для совершенствования технологических процессов получения и использования гидроперекисей является всестороннее и максимально полное изучение кинетических закономерностей и механизмов их получения и разложения. Скорость и селективность окислительных процессов, во многом определяется выбором каталитической системы. Известно, что краун-эфиры могут выступать в качестве катализаторов «мягкого инициирования» процессов окисления [4; 1], образуя различной степени стабильные комплексы. В связи с этим нами было исследовано влияние дибензо-18-краун-эфира-6 (ДБ-18-К-6) на процесс распада гидропероксида изопропилбензола (ГПИПБ).
Для разложения ГПИПБ применяли ампульный метод, реакцию проводили в среде хлорбензола при температуре 120°С и начальных концентрациях гидропероксида от 0 до 2.0 моль/л и ДБ-18-К-6 от 0 до 7.5 ×10–3 моль/л. Предварительно было установлено [5], что скорость термического распада ГПИПБ в концентрациях до 3.5 моль/л описывается уравнением первого порядка: W = 9.77 × 108 × [ГПИПБ]. Скорость термического распада вычитали из экспериментально найденной общей скорости реакции.
На рис. 1 представлена зависимость скорости распада гидропероксида изопропилбензола от его концентрации в присутствии катализатора при температуре 120°С. Как видно, ДБ-18-К-6 ускоряет распад исследуемого гидропероксида. На начальных участках величина w0 при фиксированной концентрации катализатора пропорциональна концентрации ГПИПБ, что свидетельствует о первом порядке реакции по гидропероксиду. При дальнейшем возрастании [ГПИПБ]0 порядок по гидропероксиду изменяется с первого до близкого к нулевому, что является кинетическим доказательством образования промежуточного активированного комплекса ГПК с катализатором. Возможно предположить протекание процесса комплексообразования между молекулой гидропероксида и краун-эфира, которое осуществляется благодаря образованию водородных связей между О-атомами макроцикла и Н-атомами ГПИПБ.
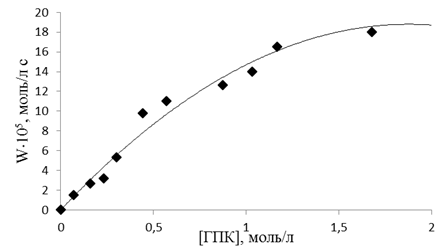
Рисунок 1. Зависимость скорости распада гидроксида изопропилбензола при 120°С от концентрации ГПИПБ в присутствии [ДБ-18-К-6]0=5´10-3 моль/л
Определенная нами скорость распада гидропероксида в присутствии краун-эфира линейно зависит от концентрации катализатора (рис. 2). Следовательно, реакция имеет первый порядок по концентрации катализатора. Таким образом, можно сделать вывод, что растворитель-хлорбензол не препятствует каталитической деятельности краун-эфира, вступая с ним в реакцию комплексообразования. Однако при дальнейшем изучении следует глубже изучить механизм взаимодействия краун-эфира с хлорбензолом.

Рисунок 2. Зависимость скорости распада гидроксида изопропилбензола при 120°С от концентрации ДБ-18-К-6, [ГПИПБ]0=0,2 моль/л
Нами был проведен анализ продуктов термического и каталитического гомолиза ГПИПБ. Продукты анализировались методом газожидкостной хроматографии («Хроматэк-Кристалл», капиллярная колонка c полярной фазой, носитель – полиэтиленгликоль). В составе продуктов обнаружены метанол, ацетофенон (АФ), диметилфенилкарбинол (ДМФК), ацетон, фенол, α-метилстирол (α-МС) и формальдегид (ФА) в различных соотношениях[6].
В рамках квантово-химических расчётов была оценена энергия активации каталитического комплекса и характер его распада. Расчёты проводились в программном пакете Priroda с использованием метода теории функционала плотности PBE. Для описания всех атомов использовался базисный набор 6-31G(d,p). Проводилась полная оптимизация всех геометрических параметров, после чего рассчитывались частоты нормальных колебаний. Отсутствие мнимых мод свидетельствовало о достижении минимума энергии. На основе частотного анализа в рамках программного пакета Priroda рассчитывались значения энтальпии, энтропии и свободной энергии Гиббса. Значения энергии сольватации рассчитывались с использованием программного пакета Gaussian 09 в том же приближении в самосогласованной модели реакционного поля (SCRF). В результате были получены термодинамические характеристики компонентов реакционной массы и их структуры.
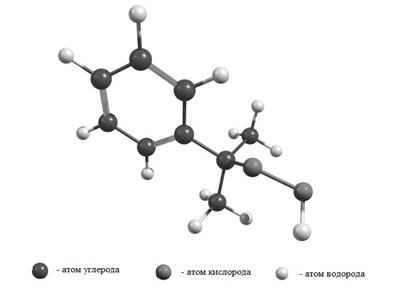
Рисунок 3. Оптимизированная геометрическая структура ГПИПБ
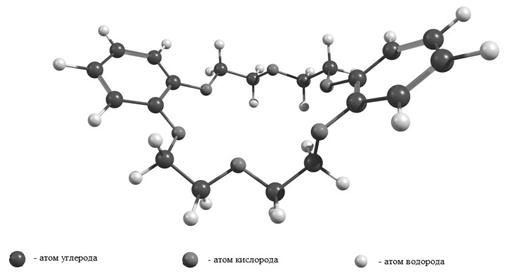
Рисунок 4. Оптимизированная геометрическая структура молекулы
дибензо-18-краун-6 эфира
По результатам исследования, можем заключить, что в состав промежуточного соединения входят две молекулы ГПК и одна молекула катализатора. Как видно из данных таблицы 1 образование комплексов состава ДБ-18-К-6•ROOH и ДБ-18-К-6•2ROOH термодинамически возможно, однако более вероятно протекания формирования соединения ДБ-18-К-6•2ROOH. Исходя из условия равновесности образования интермедиата, а также с учетом того, что в растворе концентрация гидропероксида кумола значительно превышает концентрацию присутствующего в реакционной массе катализатора, можем утверждать, что количество активированного комплекса, включающего в себя две молекулы ГПИПБ, в системе будет превалировать.
Таблица 1.
Энтальпия образования активированного комплекса kat•ROOH, включающего разное количество молекул реагента
|
Параметр Комплекс |
ДБ-18-К-6•ROOH |
ДБ-18-К-6•2ROOH |
ДБ-18-К-6•3ROOH |
|
ΔH0298, кДж/моль |
-47,3 |
-96,2 |
не определяется вследствие невозможности существования структуры |
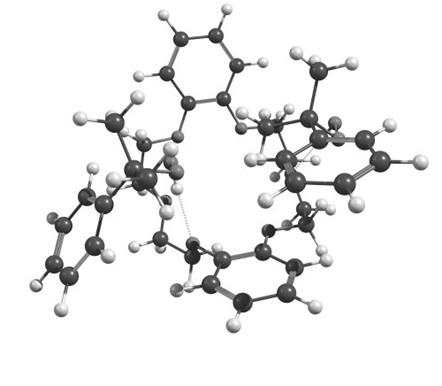
Рисунок 5. Оптимизированная геометрическая структура активированного комплекса состава 2ROOH•ДБ-18-К-6
Рассчитанные нами значения энтальпии образования переходного состояния гидропероксида кумола при термораспаде и его распад на радикалы RO· и ОН· равны 191 кДж/моль и 18,1 кДж/моль, соответственно. Суммарное значение необходимой для превращения энергии равно 209,1 кДж/моль.
Данные, полученные теоретическим методом, подтверждают каталитическое влияние краун-эфира, снижая энергетический барьер распада по сравнению с некаталитическим. Причем, расчет показывает, что разложение ГПИПБ под действием катализатора протекает ступенчато (табл. 2).
Механизм каталитического разложения гидропероксида кумола под действием дибензо-18-краун-6 эфира
2ROOH + ДБ-18-К-6  [2ROOH • ДБ-18-К-6] (1)
[2ROOH • ДБ-18-К-6] (1)
[2ROOH • ДБ-18-К-6]→ RO· +[ROOH • ДБ-18-К-6OH·] (2)
[ROOH • ДБ-18-К-6 OH·]→ОН· + [ROOH • ДБ-18-К-6] (3)
[ROOH • ДБ-18-К-6]→ RO· +[ ДБ-18-К-6 • OH·] (4)
[ДБ-18-К-6 • OH·]→ОН· + ДБ-18-К-6 (5)
Таблица 2.
Термодинамический параметр протекания ступенчатого разложения ГПИПБ в присутствии дибензо-18-краун-6 эфира
|
стадия параметр |
1 стадия |
2 стадия |
3 стадия |
4 стадия |
5 стадия |
|
ΔH0298, кДж/моль |
-96,2 |
182,6 |
75,4 |
149,8 |
106,5 |
По результатам квантово-химического исследования гомогенного разложения ГПИПБ в среде хлорбензола, мы можем считать, что хлорбензол не оказывает значительного влияния на ход процесса. Расчетные данные показывают, что разница значений свободной энергии Гиббса для газовой фазы и в хлорбензоле, соответственно, составляет около 1%:
2ROOH + ДБ-18-К-6® 2 RO· + 2 ОН· + ДБ-18-К-6
ΔG0298(в газовой фазе) = 320,9 кДж/моль
ΔG0298 (в хлорбензоле)= 317,1 кДж/моль
Итак, дибензо-18-краун-эфир катализирует процесс гомогенного разложения гидропероксида изопропилбензола, причем растворитель – хлорбензол проявляет инертность по отношению к данной реакции.

