ПОЛУЧЕНИЕ ХЛОРНОВАТИСТОЙ КИСЛОТЫ ПУТЕМ ХЛОРИРОВАНИЯ СУСПЕНЗИИ ОКСИДА ВИСМУТА (III) В ВОДЕ
Секция: 1. Химические науки

XXXIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ПОЛУЧЕНИЕ ХЛОРНОВАТИСТОЙ КИСЛОТЫ ПУТЕМ ХЛОРИРОВАНИЯ СУСПЕНЗИИ ОКСИДА ВИСМУТА (III) В ВОДЕ
Введение
Из всех производных хлора, немалую роль в химии играют кислородсодержащие соединения (хлорная, хлорноватая, хлористая, хлорноватистая кислота). В кислородсодержащих соединениях, в частности в оксокислотах, хлор проявляет положительную степень окисления, что характеризует его как сильный окислитель. Самым сильным окислителем из списка оксокислот является хлорноватистая кислота (HClO) [1]. В ряду своих особенностей HClO не может храниться в растворе длительное время, а в чистом виде не может существовать. Также существуют трудности в её получении, связанные с отделением Cl– от целевого продукта [2]. Одним из ключевых способов её синтеза является дисмутация хлора в воде:
Cl2 + H2O ó HCl + HClO (реакция 1) [3]
Существует множество способов отделения Cl− от хлорноватистой кислоты с применением таких агентов как: желтый оксид ртути, оксид серебра (I), карбонат кальция. В силу токсичности использования HgO, дороговизны Ag2O, сложности очистки продукта от образующегося раствора хлорида кальция при использовании CaCO3, целесообразным решением будет использование оксида висмута (III) [5]. Литературные данные по применению Bi2O3 в качестве нейтрализатора хлорид-ионов при синтезе хлорноватистой кислоты отсутствуют. Преимуществом использования оксида висмута (III) в процессе синтеза является его относительная дешевизна.
Цель работы:
Исследовать метод получения хлорноватистой кислоты путем пропускания хлора через суспензию оксида висмута (III) в воде и определить экспериментальный выход продукта.
Ход эксперимента
I. Получение хлорноватистой кислоты
Для проведения опыта мы воспользовались расчетными данными [4] и схемой 1. В химическом стакане была приготовлена суспензия в воде Bi2O3 массой 47,067 г, собран прибор для получения хлора (рисунок 1). Хлор был получен в ходе электролиза концентрированного раствора хлорида натрия, т.к. такой хлор не содержит хлороводород, который способен смещать равновесие реакции 1 в сторону исходных веществ.
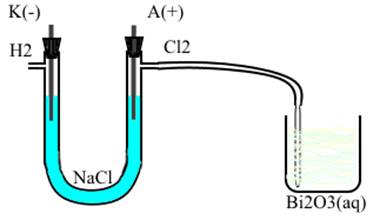
Рисунок 1. Прибор для получения хлора (при поступлении хлора в химический стакан происходит образование хлорноватистой кислоты)
Газоотводная трубка, присоединенная к анодной части электролизера, была опущена в стакан с суспензией. При включении источника тока в цепь электролизера, началось выделение хлора.
Процессы, происходящие в растворе:
Cl2 + H2O = HCl + HClO (реакция 2)
Bi2O3 + 6 HCl = 2 BiCl3 + 3 H2O (реакция 3)
BiCl3 + H2O = BiOCl + 2 HCl (реакция 4)
Первоначально суспензия имела мутный бело-желтый цвет, после начала эксперимента цвет постепенно менялся на белый, а размер частиц осадка был заметно крупнее первоначального. При данных исходных условиях, опыт длился чуть более двух часов и его конец определялся невозможностью хлора в дальнейшем растворяться, а также при взбалтывании осадка он быстро оседал и раствор становился прозрачным. В результате мы получили 97,3 мл раствора.
II.Определение выхода хлорноватистой кислоты
Для определения выхода кислоты было использован метод иодометрии [6], т.к. органические индикаторы разлагаются под действием хлорноватистой кислоты. В анализированную пробу HClO был добавлен KI. Титрование проводилось тиосульфатом натрия:
HOCl + 2KI = I2 + KCl + KOH (реакция 5)
I2 + Na2S2O3 = Na2S4O6 + 2 NaI (реакция 6)
Концентрация HClO определенная титрометрическим способом составила:
C(1/zHClO)=1,76 моль/л.
Количественный выход составил:
η(HClO)=84,16%.
Обсуждение результатов
Хлорноватистая кислота даже в разбавленном растворе постепенно распадается. В растворе испытывает три различных типа превращений, которые протекают независимо друг от друга [5]:
HClO = НCl + O (реакция 7)
HClO = Н2O + Сl2O (реакция 8)
HClO = 2НСl + НСlO3 (реакция 9)
В связи с этим выход продукта существенно снижается. Также выход снижает соляная кислота, образующаяся в ходе гидролиза BiCl3 и нейтрализующая хлорноватистую (по обратной реакции 1).
Вывод
Исследовали метод получения хлорноватистой кислоты путем пропускания хлора через суспензию оксида висмута (III) в воде и определили экспериментальный выход продукта.





