Исследование взаимодействия белков Xmas-2 и Orc3 D. melanogaster
Конференция: XXVII Международная научно-практическая конференция «Научный форум: инновационная наука»
Секция: Биология

XXVII Международная научно-практическая конференция «Научный форум: инновационная наука»
Исследование взаимодействия белков Xmas-2 и Orc3 D. melanogaster
Investigation of D.melanogaster Xmas-2 and Orc3 proteins interaction
Maria Kurshakova
PhD, Institute of Gene Biology RAS, Russia, Moscow
Аннотация. Ранее у D. melanogaster был выделен совместный комплекс TREX-2, который участвует в экспорте мРНК из ядра в цитоплазму, c белками ORC. Целью было изучить, какие участки аминокислотной последовательности Xmas-2, платформы для сборки TREX-2, участвуют во взаимодействии с белком Orc3 в составе TREX-2-ORC комплекса. Показано, что в связывании белка Xmas-2 c Orc3 участвует С-концевая последовательность Xmas-2.
Abstract. Previously the common protein complex of TREX-2, participating in mRNA export from the nucleus to the cytoplasm, with ORC proteins was purified. Our goal was to investigate what regions of scaffold protein Xmas-2 participate in Xmas-2 interaction with Orc3 in TREX-2-ORC complex. We found that C-terminal part of Xmas-2 participates in the interaction of Xmas-2 with Orc3.
Ключевые слова: Xmas-2; Orc3; TREX-2; mRNA export.
Keywords: Xmas-2; Orc3; TREX-2; mRNA export.
Введение. Синтез и процессинг мРНК происходит в ядре, а трансляция мРНК в белки – в цитоплазме, поэтому мРНК должны быть экспортированы из ядра в цитоплазму через ядерные поры. Таким образом, экспорт мРНК является важным этапом экспрессии генов.
Экспорт и другие стадии метаболизма мРНК регулируются РНК-связывающими белками, которые, связываясь с мРНК либо на короткий промежуток времени, либо сопутствуя ей на длительном участке экспортного пути, образуют мРНП частицу.
Состав мРНП частицы весьма динамичен, большое количество различных белков и белковых комплексов связывается с мРНК в ходе процессинга и экспорта. Одним из них является комплекс TREX-2.
Комплекс TREX-2 был впервые выделен у дрожжей, в его состав входят белок Sac3, две молекулы белка Sus1, белки Cdc31, Thp1, а также кофактор Sem1p, влияющий на стабильность комплекса [1, 2].
У дрожжей делеция любой из субъединиц TREX-2 приводит к нарушениям экспорта мРНК [1-4]. Комплексы, аналогичные TREX-2 дрожжей, были обнаружены у D. melanogaster, растений и человека [5-8].
Sac3 (Xmas-2 у D. melanogaster) является центральной субъединицей TREX-2 и служит платформой для сборки остальных субъединиц комплекса, а также обеспечивает взаимодействие TREX-2 с другими белками. N-концевая часть Sac3 содержит консервативный домен, который вместе с коротким N-концевым доменом связывается с экспортными адаптерами Mex67-Mtr2. N-конец Sac3 также отвечает за связывание с мРНК и участвует во взаимодействии с Thp1 и Sem1p [9]. Делеция этого домена вызывает нарушения экcпорта мРНК и роста у дрожжей. C-концевая часть Sac3 взаимодействует с двумя копиями Sus1 и Cdc31 [7, 10], делеция Sac3 CID домена приводит к потере Sus1 и Cdc31 из TREX-2 комплекса, а также к нарушениям экспорта мРНК и связывания TREX-2 с NPC [2]. Показано, что аналогичные различные участки белка человека GANP (гомолога Sac3) взаимодействуют с ENY2 и CETN2/CETN3 (гомологами Sus1 и Cdc31) и c PCID2 и DSS1 (гомологами Thp1 и Sem1p) [8]. Структурные исследования рекомбинантного комплекса GANP-ENY2 выявил, что GANP связывает две молекулы ENY2 аналогично комплексу у дрожжей. Предполагают, что TREX-2 у высших эукариот имеет сходную структуру с комплексом у дрожжей.
В нашей группе был описан TREX-2 D.melanogaster [5]. TREX-2 ассоциирован с ядерной порой и необходим для экспорта мРНК. Основу комплекса составляет скаффолд, образованный белком Xmas-2, который является ортологом Sac3, с которым взаимодействуют белки ENY2, PCID2 (соответствуют дрожжевым Sus1, Thp1). Затем в нашей группе был выделен общий комплекс TREX-2 c белками ORC комплекса [11]. ORC комплекс был впервые открыт у дрожжей, где было показано, что он распознает сайты начала репликации и необходим для инициации репликации. Однако гомологичные ORC комплексы, найденные у высших эукариот, обладают дополнительными функциями, отличными от репликативных [12]. Нами было показано, что ORC ассоциирован с мРНП частицей и это взаимодействие зависит от TREX-2 [11]. Субъединицы ORC взаимодействуют с экспортным адаптером NXF1 и влияют на связывание NXF1 с мРНП частицей. Показано, что ORC необходимы для экспорта мРНК из ядра в цитоплазму. Предложено, что ORC совместно с TREX-2 является компонентом мРНП частицы, участвующем на каком-то этапе в экспортном пути от сайтов транскрипции, находящихся внутри ядра, до ядерных пор. Из всех ORC белков Orc3 является наиболее сильно взаимодействующим с субъединицами TREX-2 и мРНП частицей.
Мы поставили цель изучить какие участки аминокислотной последовательности Xmas-2, скаффолд-белка TREX-2, участвуют в связывании белка Orc3 в составе TREX-2-ORC комплекса D. melanogaster. Полученные результаты позволяют предположить, что в связывании белка Xmas-2 c Orc3 участвует С-концевая последовательность Xmas-2.
Материалы и методы. Клонирование: участки кодирующей последовательности Xmas-2 были клонированы в вектор pAc5.1/V5 His B (Invitrogen) в одной рамке считывания с тремя FLAG эпитопами на N-конце. Кодирующая последовательность Orc3 была клонирована в вектор pAc5.1/V5 His (Invitrogen) в одной рамке считывания с НА эпитопом на С-конце.
Трансфекция: трансфекция Schneider-2 (S2) клеток D. melanogaster производилась при помощи MACSfectin Reagent (Miltenyi Biotec) по протоколу производителя.
Клеточные экстракты клеток D. Melanogaster: S2 клетки D. melanogaster поддерживались при 25С в Schneider’s insect medium (Sigma), содержащей 10% фетальной сыворотки крупного рогатого скота (HyClone). Для экстракции белков S2 клетки подвергались лизису в 10 мМ HEPES pH7.9, содержащем 5 мM MgCl2, 0,5% NP-40, 0,4 M NaCl, 1 мM DTT, complete protease inhibitor coctail (Roche), 0,6 ед./мл DNAse I, 10 ед./мл RNAse A. Клетки инкубировали в лизирующем растворе в течении 20 мин во льду, затем лизат центрифугировали при 13000 об./мин. в течении 15 минут при 4°С.
Иммуносоосаждение: 100 мкл лизата S2 клеток в буфере 10 мМ HEPES pH7.9, содержащем 5 мM MgCl2, 0,1% NP-40, 0,1 M NaCl, 1 мM DTT, complete protease inhibitor coctail (Roche), 0,6 ед./мл DNAse I, 10 ед./мл RNAse A, инкубировали с 15 мкл anti-FLAG агарозы (Sigma), с 5 мкл anti-HA агарозы (Sigma), или с 20 мкл белок-A сефарозой (Pharmacia) при 4°С в течении ночи. Затем после отбора надосадочной жидкости осажденную сефарозу или агарозу отмывали три раза по 10 минут в буфере IP500 (10 мМ HEPES pH7.9, 5 мM MgCl2, 10% glycerol, 500 мМ KCl, 0,1% NP-40). К осажденной сефарозе или агарозе добавляли по 20 мкл буфера для нанесения, надосадочную жидкость после кипячения и центрифугирования анализировали при помощи электрофореза в полиакриламидном геле и Вестерн-блот анализа по стандартным условиям.
Антитела: для детекции белков в Вестерн-блот анализе использовали антитела против FLAG эпитопа (M2) (Sigma) и антитела против HA эпитопа (Sigma).
Результаты. Orc3 сильнее остальных белков ORC взаимодействовал с компонентами TREX-2 белками Xmas-2 и ENY2 в экспериментах по иммуносоосаждению белков из ядерных экстрактов клеток D. Melanogaster [11]. Также в этих экспериментах было обнаружено, что антитела против Orc3 соосаждают помимо полноразмерного Xmas-2 массой 170 кДа другую форму белка Xmas-2 массой около 120 кДа. Было решено проверить, какие области Xmas-2 ответственны за связывание с Orc3. С этой целью были созданы экспрессионные конструкции, кодирующие различные участки белка Xmas-2 в одной рамке считывания с FLAG эпитопом (Рис.1).
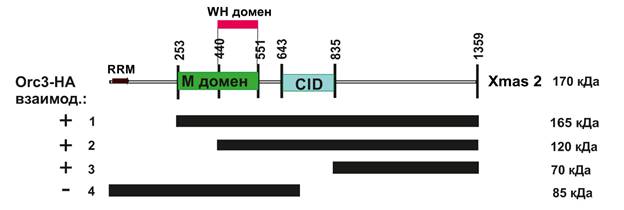
Рисунок 1. Схема белка Xmas-2 и Xmas-2-FLAG фрагментов. Схематическое изображение доменной организации белка Xmas-2: обозначены RRM-домен, M-домен, WH-домен, CID-домен. Отмечены позиции а.о., обозначающие границы доменов. Схематическое изображение участков Xmas-2, использованных для создания Xmas-2-FLAG рекомбинантных белков. Слева показан результат проверки взаимодействия протестированных фрагментов Xmas-2-FLAG c Оrc3-HA, где «+» обозначает взаимодействие, а «-» обозначает отсутствие взаимодействия
Xmas-2 содержит несколько доменов: RRM-домен, М-домен, WH-домен и CID- домен. RRM-домен и М-домен расположены на N-конце белка и осуществляют взаимодействие с РНК. Расположенный внутри М-домена WH-домен участвует во взаимодействии с Thp1. CID-домен необходим для взаимодействия с ENY2. С-конец Xmas-2 вариабелен между различными эукариотическими организмами и не содержит определенного мотива. Первая конструкция (253-1359 а.о.) содержит последовательности, кодирующие M-домен и CID-домен, а также участок С-концевой последовательности Xmas-2. Вторая конструкция (440-1359 а.о.) представляет собой укороченный c N-конца вариант первой конструкции и содержит WH-домен и CID-домен, при этом М-домен нарушен. Третья конструкция (835-1359 а.о.) содержит C-концевой участок Xmas-2. Четвертая конструкция (1-670 а.о.) содержит N-концевую последовательность Xmas-2, CID-домен при этом нарушен.
Полученными конструкциями Xmas-2 фрагментов с FLAG тагом были трансформированы S2 клетки D. melanogaster, подобраны условия трансформации для максимальной экспрессии белков в клеточной культуре. Были проведены эксперименты по соосаждению Xmas-2-FLAG фрагментов с белком Orc3-HA из тотальных лизатов котрансформированных клеток. В качестве положительного контроля проводили соосаждение полноразмерного Xmas-2-FLAG совместно с Orc3-HA. Антитела к FLAG эпитопу осадили соответствующие рекомбинантные белки: для фрагмента Xmas-2 253-1359 а.о. – белок массой около 165 кДа, для фрагмента 440-1359 а.о. – 120 кДа, для фрагмента 835-1359 а.о. – 70 кДа, для фрагмента 1-670 а.о. – 85 кДа.
В наших условиях антитела к FLAG соосадили Orc3-HA вместе с Xmas-2 фрагментом, соответствующем С-концевому фрагменту 835-1359 а.о. В случае других Xmas-2 фрагментов взаимодействие с Orc3-HA не удалось детектировать. Антитела к HA эпитопу осадили Orc3-HA и соосадили первый (253-1359 а.о.) и третий (835-1359 а.о) Xmas-2-FLAG фрагменты: оба эти фрагмента содержат участок С-концевой аминокислотной последовательности Xmas-2, соответствующий 835-1359 а.о. Взаимодействия между Orc3-HA и 440-1359 а.о. фрагментом Xmas-2-FLAG обнаружить не удалось, что может быть связано с сравнительно более низким уровнем экспрессии этого фрагмента в S2 клетках.
Взаимодействия между Orc3-HA и N-концевой последовательностью Xmas-2 не было детектировано.
Полученные результаты позволяют предположить, что взаимодействие Xmas-2 и Orc3 в составе TREX-2-ORC комплекса осуществляется через область на С-конце Xmas-2. N-конец Xmas-2 и содержащие там M-домен, WH-домен и CID-домен не играют ключевой роли во взаимодействии Xmas-2 и Orc3.
Ранее было предложено, что Orc3 ассоциируется с Xmas-2 при участии двух молекул ENY2, которые связываются с С-концевой частью Xmas-2.
Полученные нами данные подтверждают эту гипотезу, указывая на то, что Orc3 связывается с C-концевой областью Xmas-2.
Благодарности. Работа была поддержана грантом РФФИ № 19-04-00861.


