ПРОТИВОГОЛОЛЁДНЫЕ РЕАГЕНТЫ И ДРУГИЕ ПРАКТИЧЕСКИЕ ПРИМЕНЕНИЯ ЗАКОНА РАУЛЯ
Секция: 1. Химические науки

XXXV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ПРОТИВОГОЛОЛЁДНЫЕ РЕАГЕНТЫ И ДРУГИЕ ПРАКТИЧЕСКИЕ ПРИМЕНЕНИЯ ЗАКОНА РАУЛЯ
На сегодняшний день в практических целях применяются как жидкие, так и твердые противогололедные средства. Твердые реагенты после контакта со снегом или льдом начинают активно поглощать влагу, что сопровождается переходом их в жидкое состояние, в процессе которого происходит выделение тепла (т.е. наблюдается экзотермический процесс). Данный факт приводит к дополнительному растапливанию снега. Образующийся в результате рассмотренного взаимодействия рассол (из растопленного снега, льда и реагента) имеет температуру замерзания ниже температуры замерзания воды, что предотвращает повторное образование гололеда. При этом твердые реагенты чаще применяются в более влажную погоду, а более сухую погоду – твердые.
В качестве жидких противогололедных средств могут применяться: ацетат аммония модифицированный CH3CООNН4 - «Антиснег-1»; хлористый кальций CaCl2 модифицированный (ХКМ), содержащий ингибитор коррозии; ацетат калия СН3СООК модифицированный - «Нордикс» или «Ацедор», а в качестве твердых: соль техническая NaCl; хлористый кальций – натрий модифицированный – «Айсмелт» (ХКНМ); хлористый кальций, ингибированный фосфатами (ХКФ); хлористый магний модифицированный MgCl2 – «Биомаг»; нитрат кальция Ca(NO3)2; нитрат магния Mg(NO3)2.
В рамках экспериментального исследования закона Рауля был определен изотонический коэффициент методом криоскопии. Исследовался водный раствор хлорида натрия (NaCl), который является электролитом. В данном случае изотонический коэффициент может быть определен из уравнения:
 , (1)
, (1)
где: α – степень диссоциации,
v – фактическое число частиц, образующихся при диссоциации из одной молекулы электролита.
Для исследуемого хлорида натрия NaCl α = 0,84 (84%), v = 2 (NaCl↔Na++Cl-). Тогда теоретическое значение изотонического коэффициента будет равно:

В ходе эксперимента были определены температуры, при которых замерзания растворителя и раствора, а затем по этим величинам определено экспериментальное значение изотонического коэффициента i.
В работе применялся калориметр, состоящий из двух стаканов (рисунок 1), заполненный охлаждающей смесью из снега, хлорида натрия (30-40%) и воды. Температура данной смеси первоначально составляла -5–70С.

Рисунок 1. Внешний вид экспериментальной установки
Измерение температуры производилось при помощи термометра, размещенного таким образом, чтобы резервуар термометра был ниже уровня жидкости на 5–10 мм.
На первом этапе эксперимента исследовался процесс замерзания дистиллированной воды, для чего в калориметр была помещена пробирка, содержащая 5 мл дистиллированной воды. Полученная при этом зависимость температуры дистиллированной воды от времени представлена на рисунке 2.

Рисунок 2. Экспериментальная зависимость температуры дистиллированной воды от времени охлаждения
Из данных, приведенных на рисунке 2, видно, что наблюдается процесс переохлаждения, в процессе которого температура воды снизилась ниже температуры замерзания, а после начала кристаллизации повысилась до постоянного значения. Данное значение является экспериментально определенной температурой замерзания чистого растворителя.
На втором этапе эксперимента исследовалась температура замерзания раствор NaCl. В ходе эксперимента исследовался раствор с концентрацией растворителя 0,47 моль/кг. Полученная в результате эксперимента зависимость температуры раствора от времени представлена на рисунке 3.

Рисунок 3. Экспериментальная зависимость температуры раствора NaCl от времени охлаждения
Из анализа приведенных на рисунке 3 данных, очевидно, температура кристаллизации растворителя из раствора с выбранной концентрацией соответствует температуре Т1 = -1,50С. Необходимо отметить, что температура окружающей среды в период проведения эксперимента колебалась в диапазоне 21–230С. и в ходе проведения эксперимента была достигнута температура раствора -5 0С; при которой полного замерзания раствора еще не наблюдалось.
определим значение изотонического коэффициента по результатам эксперимента:
 , (2)
, (2)
где: ΔT – понижение температуры замерзания, 0С
Cm – молярная концентрация, моль/кг;
К – криоскопическая постоянная, 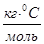
По расчету:

Сравнение найденного значения с теоретическим показывает разницу в 7,5%, что свидетельствует о достаточной точности эксперимента.





