ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ НАНОЧАСТИЦ ДИОКСИДА ЦЕРИЯ
Секция: 2. Биологические науки

XXX Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ НАНОЧАСТИЦ ДИОКСИДА ЦЕРИЯ
Введение. В настоящее время все чаще внедряют нанотехнологии в различные области науки. Одна из таких областей является медицина. Наночастицы обладают уникальными свойствами по отношению к окружающей среде, особенно к биологическим объектам. На данный момент существует огромное количество публикаций на тему биологических исследований свойств наночастиц, полученных при различных условиях, т.к. при их изменении существенно меняются свойства наночастиц [3]. Одними из наиболее перспективных являются наночастицы диоксида церия, у которых наблюдаются дифференцированные свойства по отношению к здоровым и опухолевым клеткам: в малых концентрациях они способны защищать здоровые клетки от канцерогенов, при увеличении концентрации – способствуют гибели раковых клеток при сохранении жизнеспособности здоровых. На данный момент в мире наиболее широко исследуется воздействие наночастиц, полученных химическими способами [2], в то время как свойства наночастиц, полученных с помощью физических установок, практически не изучено, хотя они ни чем не уступают, а иногда и превосходят, по своим качествам «химические» наночастицы.
Материалы. В исследовании использовались наночастицы диоксида церия, полученные методом испарения импульсным пучком в атмосфере разреженного газа [1]. Размер наночастиц – 3-5 нм. Суспензии наночастиц готовились в дистиллированной воде в концентрациях 5, 20, 50, 100, 200 и 400 мкг/мл. Наночастицы были стабилизированы цитратом натрия в соотношении 1:1, а затем озвучены на установке УЗДН-2Т в течение 45 минут. Размер агломератов в суспензии и дзета-потенциал наночастиц были измерены с использованием системы Zetasizer Nano ZS (Malvern).
Биологическое исследование. Для исследования биологической активности были использованы перевиваемые линии рабдомиосаркомы человека RD, карциномы шейки матки человека Hela, эмбриональные клетки почки человека HEK-293, полученные из Российской коллекции клеточных культур Института цитологии РАН, г. Санкт-Петербург, Россия, а также первичная культура дермальных фибробластов человека выделенные из биоптата кожи в Институте медицинских клеточных технологий, г. Екатеринбург, Россия.
Клетки рассевали в 96-луночные планшеты в посевной дозе 2x105 кл/мл и культивировали в течение 24 часов в среде Игла DМЕМ с 1% глутамина, в присутствии 10% эмбриональной телячьей сыворотки и гентамицина (50 мг/л) при 37 °С, в увлажненной атмосфере 5%-ного СО2, после чего в лунки добавляли НЧ в различных концентрациях. Клетки инкубировали с НЧ в течение 24 часов, отмывали от среды с НЧ, инкубировали в ростовой среде 72 часа, после чего проводили оценку жизнеспособности клеток с помощью стандартного МТТ-теста [4,5].
МТТ-тест. Среду удаляют, в лунки вносят 200 мкл ростовой среды без сыворотки, добавляют 20 мкл готового раствора МТТ (исходная концентрация 5 мг/мл в фосфатном буфере), инкубируют 4 ч при 37 °С в атмосфере 5%-ного CO2. Выпавшие кристаллы формазана растворяют в 100 мкл диметилсульфоксида (ДМСО) в течение 20 минут при 37 °С. Оптическое поглощение окрашенных растворов ДМСО измеряют на планшетном сканере VICTOR X3 (Perkin Elmer, США) при длине волны 540 нм.
Опыты проводят в 3-х повторностях, с отрицательным (среда), положительными (1 мМ раствор пероксида водорода в ФСБ) контролями и контролем растворителя.
Оценку результатов теста МТТ проводят путем сопоставления оптической плотности в опытных и контрольных лунках, рассчитывая индекс цитотоксичности (IC) по формуле:
IC= (К- О) х 100%, где
К
К – оптическая плотность в контрольных пробах;
О – оптическая плотность в опытных пробах
Индекс жизнеспособности (CI):
CI= О х 100% ,
К
Результаты. Распределение наночастиц в суспензии по размерам представлено на рисунке 1. Преобладает два размерный кластера со средними размерами 148,0 и 614,2 нм. Согласно экспериментальным данным, наибольшая вероятность проникновения наночастицы внутрь клетки достигается при размерах агломератов наночастиц до 10 нм и в пределах от 200 и 400 нм. При варьировании соотношения стабилизатор:наночастицы и длительности озвучивания возможно изменять размеры агломератов в суспензии.
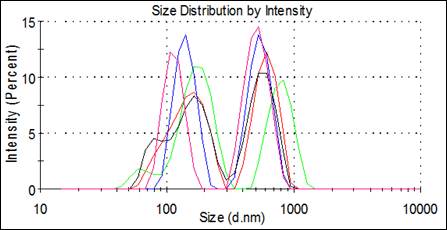
Рисунок 1. Распределение размеров наночастиц в суспензии
Дзета-потенциал агломератов наночастиц равен 40мВ и практически не зависит от распределения по размерам.
Исследование цитотоксичности было проведено с помощью МТТ-теста. Результаты жизнеспособности приведены на рисунке 2, где четко наблюдаются дифференцированные свойства суспензии по отношению к различным культурам клеток. Наночастицы практически никак не повлияли на жизнеспособность здоровых клеток - фибробластов человека (ФЧ), в то время как жизнеспособность раковых клеток – рабдомиосаркомы (Rd) и рака шейки матки (HeLa) уменьшается с увеличением концентрации суспензии. Воздействие суспензии на трансформированную линию клеток HEK-293 (по своей природе не являющиеся опухолевой) также показало дифференцированную токсичность.

Рисунок 2. Жизнеспособность опухолевых и здоровых культур клеток по отношению к разным концентрациям суспензии наночастиц
На сегодняшний момент существует несколько гипотез возникновения данного эффекта дифференцированности воздействия наночастиц в различных концентрациях на различные по своей природе культуры клеток, но ни одна из них не является общепринятой.
Культуры клеток, подверженные быстрому делению (опухолевые HeLa и Rd, и трансформированная HEK-293), обладают более кислой средой, по сравнению с нормальными клетками фибробластов человека. Это может быть ключевым звеном для объяснения природы дифференциальной активности наночастиц. При разных значениях уровня кислотности среды ионы церия могут принимать степени окисления 3+/4+ (по уравнению Фентона). В зависимости от этого увеличивается генерация активных форм кислорода, которые и способны вызвать гибель клеток.





