ТЕЛОМЕРЫ И ИХ РОЛЬ В ПРОЦЕССЕ СТАРЕНИЯ И ОБРАЗОВАНИЯ РАКОВЫХ КЛЕТОК
Секция: 4. Медицинские науки

XXIV Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ТЕЛОМЕРЫ И ИХ РОЛЬ В ПРОЦЕССЕ СТАРЕНИЯ И ОБРАЗОВАНИЯ РАКОВЫХ КЛЕТОК
Теломеры — это концевые участки хромосом. В процессе деления клетки ДНК должна делиться, при этом последняя маленькая частичка молекулярной цепи — кончик теломеры — не копируется и на протяжении нашей жизни, теломеры укорачиваются.
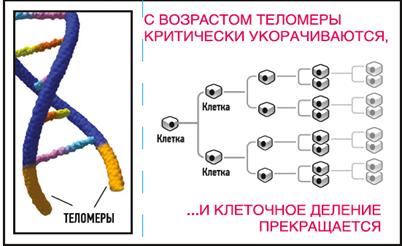
Рисунок 1. Деление теломер
По мере деления теломер клетки «стареют», хуже функционируют и при этом они начинают реже делиться, а стволовые клетки реже производить копии, и, а какому-то моменту прекращают полностью их воспроизводить. В результате у человека ухудшается зрение, кожа теряет эластичность, хуже работает иммунная система и начинают происходить ряд других изменений, связанных со старением и при этом нельзя изменить скорость возникновения главных болезней — патология сердца и сосудов, злокачественные опухоли, цереброваскулярные болезни, грипп и пневмония (инфекционные болезни), атеросклероз, сахарный диабет, бронхит, бронхиальная астма, нефриты, цирроз печени, если не удаться добиться замедления скорости старения.
При этом старение — это своего рода болезнь и задача геронтологии заключается не столько в продлении жизни, сколько в замедлении скорости старения, а значит и прогрессирования главных болезней.
В 1930 году Герман Меллер и Барбара Мак-Клинток пришли к заключению, что фрагментированные хромосомы склонны к слиянию между собой, при этом нормальные хромосомы поддерживают стабильность благодаря наличию особых концевых участков. Эти концевые участки Меллер назвал теломерами (от греческого “telos” — конец, “meros” — часть).
В 1961 г. американский ученый, профессор анатомии Калифорнийского университета Леонард Хейфлик обнаружил, что клетки способны делиться лишь ограниченное количество раз. Так было выявлено что количество делений составляет 52 делений.
В 1971 г. русский советский ученый Алексей Оловников предложил теорию, которая объясняла механизм работы такого «счетчика». По мнению А. Оловникова, при матричном синтезе полинуклеотидов ДНК-полимераза не может полностью восстанавливаться
1978 год. Элизабет Блэкберн и Джек Шостак продемонстрировали, что функция теломер заключается в защите целостности хромосом.
В 1985 году, Кэрол Грейдер обнаружила фермент теломеразу в инфузориях тетрахименах.
1990 год. Келвин Харли, главный научный сотрудник Geron Corporation, установил связь между сокращением длины теломер и клеточным старением.
В 1994 году Билл Эндрюс и его команда клонировали первый ген теломеразы.
В 1997 году был клонирован второй ген теломеразы (Билл Эндрюсом в сотрудничестве с Нобелевским лауреатом Томом Чехом).
Причины образования рака.
Длина теломер обратно пропорциональна возрасту организма, к которому они принадлежат.
В раковых клетках длина теломер незначительна, однако наличие теломеразы в 85 % случаев позволяет нивелировать эту особенность.
Активность теломеразы увеличивает риск увеличения числа раковых клеток. Вместе с тем, теломераза не является первоисточником рака.
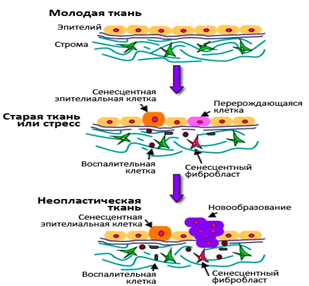
Рисунок 2. Образование раковой клетки
Теломераза реактивируется чаще в опухоли эпителиального происхождения, характерные для людей в пожилом возрасте. Считается, что реактивация теломеразы — важный этап злокачественных процессов, так как это позволяет раковым клеткам «не обращать внимания» на лимит Хейфлика. Дисфункция теломер способствует хромосомным слияниям и аберрациям, что в отсутствии p53 чаще всего приводит к злокачественным новообразованиям.
Пример бессмертия раковых клеток — это клетки HeLа, изначально полученные из опухоли шейки матки Генриетты Лекс (Henrietta Lacks, отсюда название культуры HeLa) в 1951 г. Эта культура и сейчас используется в лабораторных исследованиях. Клетки Hela в самом деле бессмертны: по оценкам ежедневно производится несколько тонн этих клеток, причём все они являются потомками нескольких клеток, извлечённых из опухоли Г. Лекс.
Список литературы:
1. Ата Мамедов. Краткая история теломер или путь к нобелевской премии.
2. Серецкий Г., фон Цглиники. Репликационное старение, теломеры и оксидативный стресс // Аnn/ N. Acad. Sci. — 2002 — 959. — 2429.
3. Hoffmeyer K., A. Raggioli, S. Rudloff, R. Anton, A. Hierholzer, I. Del Valle, K. Hein, R. Vogt, R. Kemler. Wnt / β-Catenin Signaling Regulates Telomerase in Stem Cells and Cancer Cells. Science, 2012; 336 (6088): 1549—1554 DOI: 10.1126/science.1218370.





