АНАЛИЗ СОДЕРЖАНИЯ НЕКОТОРЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В ВИТАМИНОСОДЕРЖАЩЕМ ЛЕКАРСТВЕННОМ РАСТИТЕЛЬНОМ СЫРЬЕ
Секция: 4. Медицинские науки

XXIII Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
АНАЛИЗ СОДЕРЖАНИЯ НЕКОТОРЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В ВИТАМИНОСОДЕРЖАЩЕМ ЛЕКАРСТВЕННОМ РАСТИТЕЛЬНОМ СЫРЬЕ
Витамины — сложные биологически активные органические вещества растительного, реже животного происхождения, имеющие различную химическую структуру. Они не образуются в достаточном количестве клетками человеческого организма, но в небольших дозах обязательны для нормальной жизнедеятельности организма [1].
Большинство растений содержат витамины, но витаминосодержащими называют те растения, которые избирательно накапливают витамины в дозах, способных оказывать выраженный фармакологический эффект.
Роль витаминов в наше время достаточно велика, так как они выполняют функции регуляторов обмена веществ и практически влияют на все биохимические процессы. А присутствие сопутствующих веществ (дубильные вещества, флавоноиды и т. д.) усиливают и расширяют фармакологические эффекты витаминов и тем самым их применение [1]. Так, помимо витаминной активности, такие растения обладают и кровоостанавливающим, ранозаживляющим, противовоспалительным действием.
Витамины встречаются в растениях практически всех семейств. И практически все витамины способны синтезироваться растениями. При этом концентрация одних витаминов (группа В, кислота фолиевая) в большинстве растений малы и примерно, одинаковы, других (витамины К, кислота никотиновая, биотин) существенно отличаются, при этом остаются небольшими. В высоких концентрациях способны накапливаться только кислота аскорбиновая, каротиноиды и некоторые флавоноиды, относимые к витамину Р. Витамины скапливаются в зеленых частях растений, цветках, плодах (витамины С и Р) и семенах (витамины Е и Р).
Целью работы явился сравнительный анализ содержания кислоты аскорбиновой, дубильных веществ и флавоноидов в витаминосодержащем лекарственном растительном сырье (плоды шиповника, листья крапивы, трава сушеницы топяной, трава череды).
Материалы и методы. Объектами исследования явилось официнальное сырье: плоды шиповника морщинистого (Rosa rugosa, семейство — розоцветные — Rosaceae); листья крапивы (Urtica dioica, семейство крапивные — Urticaceae); трава сушеницы топяной (Gnaphalium uliginosum, семейство астровые — Asteraceae); трава череда трехраздельная (Bidens tripartite, семейство астровые — Asteraceae).
Содержание кислоты аскорбиновой определяли методом визуального титрования. В данном методе использовали окислительно-восстановительную реакцию с 2,6-дихлорфенолиндофенолятом натрия (реактивом Тильманса) [3]. Данный метод основан на редуцирующих свойствах кислоты аскорбиновой. Синяя окраска (индикатор) переходит в бесцветное соединение (реакция Тильманса) 2,6-дихлорфенолиндофенол. Кислота аскорбиновая в растительной ткани очень быстро вступает в реакцию окисления, а затем превращается в дегидроаскорбиновую кислоту. Для количественного определения отбор средней пробы проводили методом квартования, но при этом предварительно грубо измельчали в ступке. Из этой пробы взяли навеску массой 20 г. поместили в фарфоровую ступку, где тщательно растерли со стеклянным порошком (около 5 г). Далее постепенно добавляли 300 мл воды, а после настаивали 10 мин. Затем смесь размешивали, и извлечение отфильтровывали. В коническую колбу вместимостью 100 мл переносили 1 мл полученного фильтрата, 1 мл 2 % раствора хлористоводородной кислоты, 13 мл воды, тщательно перемешали. Титровали из микробюретки раствором 2,6-дихлорфенолиндофенолята натрия до появления розовой окраски, которая не исчезает в течение 30—60 секунд. Титрование длилось около 2 минут. Расчет содержания кислоты аскорбиновой в % был произведен по формуле:
![]()
где: V — объем раствора 2,6-дихлорфенолиндофенолята натрия (0,001 моль/л), пошедшего на титрование, в мл; 0,000088 — количество аскорбиновой кислоты, соответствующее 1 мл раствора 2,6-дихлорфенолиндофенолята натрия (0,001 моль/л), в граммах; m — масса сырья в граммах; W — потеря в массе при высушивании сырья в %.
Содержание дубильных веществ определяли методом перманганатометрии. Он основан на окислении исследуемого вещества перманганатом калия. Приготовление индигосульфокислоты проходило следующим образом: 1 г индигокармина растворяли в 25 мл концентрированной серной кислоты. После чего прибавляли еще 25 мл концентрированной серной кислоты и разбавили водой до 1000 мл. Раствор осторожно вливают в воду [3]. Взяли 2 г (точная навеска) измельченного сырья, которое было просеяно сквозь сито с диаметром отверстий 3 мм. После чего поместили в коническую колбу вместимостью 500 мл и залили 250 мл кипящей водой. Кипятили с обратным холодильником на электрической плитке с закрытой спиралью в среднем 30 мин, при этом периодически перемешивали. Жидкость остужали до комнатной температуры и процедили около 100 мл в коническую колбу вместимостью 250 мл через ватный тампон так, чтобы частицы сырья не попали в колбу. Далее отобрали пипеткой 25 мл полученного извлечения в другую коническую колбу вместимостью 750 мл и прибавили 500 мл воды, 25 мл раствора индигосульфокислоты. Затем титровали, при этом постоянно перемешивали, раствором перманганата калия (0,02 моль/л) до золотисто-желтого окрашивания. Параллельно также проводили контрольный опыт. 1 мл раствора перманганата калия (0,02 моль/л) соответствует 0,004157 г дубильных веществ в пересчете на танин. Расчет содержания дубильных веществ в % в пересчете на абсолютное сухое сырье вычисляли по формуле:
![]()
где: V — объем раствора перманганата калия (0,02 моль/л), пошедшего на титрование извлечения, в мл; ![]() — объем раствора перманганата калия (0,02 моль/л), пошедшего на титрование в контрольном опыте, в миллилитрах; 0,004157 — количество дубильных веществ, соответствующее 1 мл раствора перманганата калия (0,02 моль/л) (в пересчете на танин), в граммах; m — масса сырья в граммах; W — потеря в массе при высушивании сырья в %.
— объем раствора перманганата калия (0,02 моль/л), пошедшего на титрование в контрольном опыте, в миллилитрах; 0,004157 — количество дубильных веществ, соответствующее 1 мл раствора перманганата калия (0,02 моль/л) (в пересчете на танин), в граммах; m — масса сырья в граммах; W — потеря в массе при высушивании сырья в %.
Суммарное содержание флавоноидов определяли спектрофотометрическим методом. Данный метод основан на поглощении монохроматического электромагнитного излучения и определении оптической плотности [4]. Аналитическую пробу сырья измельчили до таких размеров частиц, чтобы они проходили сквозь сито с отверстиями диаметром 1 мм. Взяли 0,5 г (точная навеска) измельченного сырья, поместили в колбу со шлифом вместимостью 100 мл и прибавляли 50 мл 70 % спирта этилового. Колбу взвесили с погрешностью ± 0,01, после чего присоединили к обратному холодильнику и нагревали на кипящей водяной бане в течение 2 ч. Затем после того как колба охладилась до комнатной температуры, ее вновь взвешивали и доводили до первоначальной массы 70 % этиловым спиртом. Содержимое колбы профильтровали через воронку диаметром 7 см в который был вложен ватный тампон и отбросили первые 20 мл фильтрата. В мерную колбу вместимостью 25 мл поместили 2 мл профильтрованного извлечения, добавили 2 мл 1 % раствора алюминия хлорида в 95 % спирте этиловом и доводили объём раствора 95 % спиртом этиловым до метки. Чтобы приготовить раствор сравнения в другую колбу вместимостью 25 мл поместили 2 мл фильтрата и довели до метки 95 % спиртом этиловым. Оптическую плотность измеряли через 29 минут на спектрофотометре при длине волны 410 нм в кювете с толщиной слоя 10 мм. Параллельно измеряли оптическую плотность раствора ГСО кверцетина. Для этого 2 мл 0,02 % раствора стандарта поместили в мерную колбу 25 мл, прибавили 2 мл 1 % раствора алюминия хлорида и доводили до метки 95 % спиртом этиловым. Расчет суммарного содержания флавоноидов в сухом сырье в пересчете на стандарт и абсолютно сухое сырье вычисляли по формуле:
![]()
где: D — оптическая плотность испытуемого раствора; m0 — масса ГСО стандарта, г; D0 — оптическая плотность раствора ГСО стандарта; m — масса сырья, г; W — потеря в массе при высушивании сырья в %.
Статистическую обработку проводили с использованием программы Microsoft Excel 2010.
Результаты исследования. По содержанию кислоты аскорбиновой максимальное количество данного БАВ было обнаружено в сырье шиповника морщинистого (6,06 ± 0,003), минимальное — сырьё череды трехраздельной (1,27 ± 0,0005) (рис. 1).
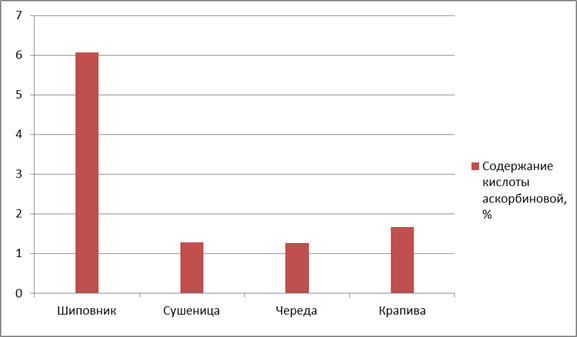
Рисунок 1. Содержание кислоты аскорбиновой в ЛРС
По содержанию дубильных веществ наибольшее значение данного показателя было обнаружено в сырье череды трехраздельной (7,2 ± 0,05) и наименьшее значение в сырье шиповника морщинистого (2,9 ± 0,03) (рис. 2).
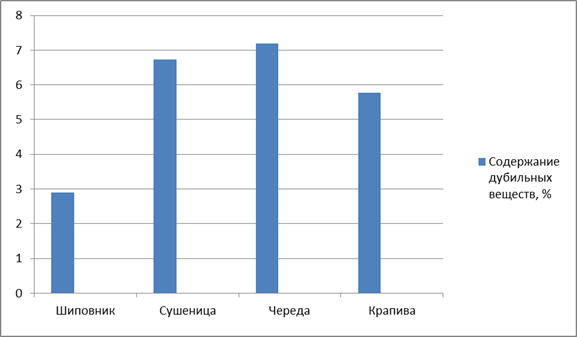
Рисунок 2. Содержание дубильных веществ в ЛРС
По содержанию флавоноидов на первое место можно поставить сырьё череды трехраздельной (2,15 ± 1,0), на второе — сырьё сушеницы топяной (1,18 ± 1,0), на третье место — сырье шиповника морщинистого (0,17 ± 1,18) (рис. 3).
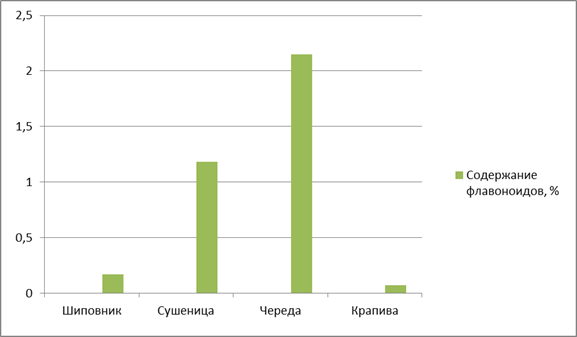
Рисунок 3. Содержание флавоноидов в ЛРС
Таким образом, установлено, что все исследуемые виды растений содержат изучаемые БАВ (кислота аскорбиновая, флаваноиды, дубильные вещества). Высокая концентрация кислоты аскорбиновой установлена в плодах шиповника морщинистого, дубильных веществ и суммарного содержания фавоноидов — в траве череды трехраздельной. Это позволяет рассматривать данные растения в качестве источников, указанных БАВ.
Список литературы:
1. Афиногенова С.Г. Витамины. Учебно-методическое пособие для студентов биолого-химического факультета / С.Г. Афиногенова, Э.А. Сидорская. — Арзамас: АГПИ им. А.П. Гайдара, 1990. — 65 с.
2. Государственная фармакопея СССР XI издания выпуск 1, — М.: Медицина, 1990. — С. 286.
3. Государственная фармакопея СССР XI издания выпуск 2, — М.: Медицина, 1990. — С. 294—297.
4. Зиэп Т.Т. Нго, Е.В. Жохова «Разработка методики количественного определения суммарного содержания флавоноидов в траве пустырника спектрофотометрическим методом», 2007. — № 4. — С. 73—77.





