ФИЗИОЛОГИЧЕСКАЯ И РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
Секция: 4. Медицинские науки

XX Студенческая международная заочная научно-практическая конференция «Молодежный научный форум: естественные и медицинские науки»
ФИЗИОЛОГИЧЕСКАЯ И РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ КОСТНОЙ ТКАНИ
Введение.
Окончательно костная масса формируется между 20 и 30 годами и какое-то время остается неизменной, но в последствии начинается естественная потеря массы костей. Мужчины ежегодно теряют около 1 % костной массы, а у женщин после менопаузы потери составляют от 2 % до 3 % ежегодно. По мере старения новая костная ткань не образуется так быстро, как теряется старая, в результате чего кости истончаются и становятся хрупкими — процесс истончения костей называется остеопорозом. Существуют клинические условия, в которых регенерация кости требуется в большем количестве, например, для реконструкции крупных дефектов скелетной костей вызванных травмой, инфекцией, удалением опухоли и скелетных аномалий. Все выше перечисленные состояния костей требуют глубокого понимания процесса регенерации.
Общие принципы регенерации костной ткани.
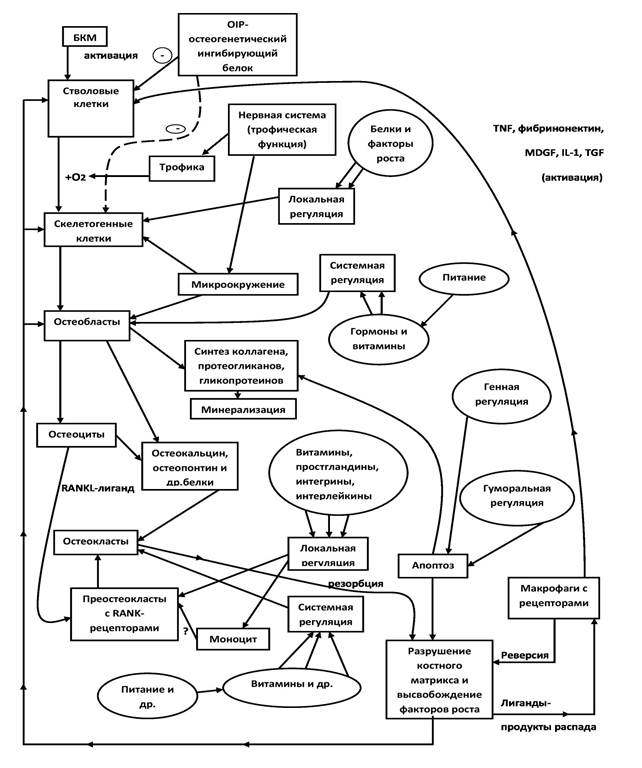
Схема «Функциональная гистобиохимическая система ремоделирования (регенерации) костной ткани» наиболее полно описывает ключевые процессы регенерации (Рис. 1). Все клетки костной ткани тесно взаимосвязаны посредством выделяемых веществ. Содержание схемы может являться основой «клинического» мышления при некоторых заболеваниях из области ревматологии, травматологии и ортопедии.
Рисунок 1. Функциональная гистобиохимическая система ремоделирования (регенерации) костной ткани
Механизмы физиологической и репаративной регенерации качественно едины, осуществляются на основе общих закономерностей. Репаративная регенерация есть в той или иной мере усиленная физиологическая регенерация.
Главный принцип ремоделирования — разрушение и восстановление костной ткани. Ремоделирование является естественным и постоянным процессом, который происходит в здоровом организме, таким образом, удаляется старая костная ткань и формируется новая. Полностью цикл ремоделирования занимает по разным данным от 40 до 120 и даже 200 дней [11, с. 5; 2, с. 97].
Характеристика основных клеток костной ткани.
Остеобластический клеточный дифферон представлен стромальными стволовыми клетками (СКК). Морфологически ССК — это фибробластоподобные клетки, находящиеся в фазе G0 клеточного цикла и составляющие, таким образом, регенеративный резерв костной ткани, мобилизуемый в условиях физиологической деятельности и при посттравматическом восстановлении. Маркер ССК — STRO-1. ССК дифференцируется в остеогенные клетки. Промежуточная стадия дифференцировки остеогенных клеток в направлении к остеобластам — преостеобласт.
Остеобласты — крупные (20—30 мкм в диаметре) округлые клетки с эксцентрично расположенным ядром и большим объемом цитоплазмы, с развитым эндоплазматическим ретикулумом и пластиночным комплексом. Молодые остеобласты 1 типа чаще встречаются в эпифизах и метафизах кости, вплотную к энхондральным очагам. Зрелые активные клетки типа 2 располагаются на костных трабекулах в зоне активного костеобразования. Гипертрофированные остеобласты типа 3 расположены только в зоне активного костеобразования [8, с. 21—22].
Остеоциты — это клетки, которые способны трансформируя механические стимулы в биохимические сигналы, инициировать процессы ремоделирования в определенном её локусе. Остеоциты имеют весьма длинные (50—60 мкм) при среднем размере тела клетки (15—45 мкм) контактирующие между собой отростки, расположенные в костных канальцах. Посредством отростков они так же контактируют с остеокластами, выстилающими клетками и остеобластами, последним отводят роль посредников сигналов в костной резорбции. Данные контакты обеспечивают переход некоторых молекул (Са2+, цАМФ) из клетки в клетку. Функциональным доказательством таких межклеточных связей в костной ткани может служить явление электропроводимости, а также скоординированный ответ группы остеобластов на локальный механический или химический стимул при ремоделировании. Зрелые остеоциты в незначительной степени способны к резорбции, поскольку содержат фосфотазу и пептидазу [8, с. 22].
Остеокласты — крупные (150—180 мкм) многоядерные клетки, резорбирующие костную ткань [8, с. 24]. Строго говоря, остеокласт — это симпласт. ССК и другие клетки микроокружения вырабатывают колониестимулирующий фактор роста гранулоцитов и макрофагов, который в сочетании с ИЛ-1 и ИЛ-3 обеспечивает фенотипические проявления остеокластов. Остеокласты имеют базальную зону (с 5—20 ядрами), светлую зону (контактирует с костным матриксом) и везикулярную зону.
На микропрепарате (окраска гематоксилином и эозином) представлены остеобласты и остеокласты (Рис. 2).
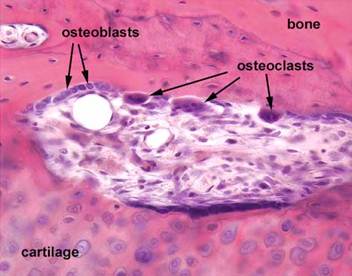
Рисунок 2. Ремоделирование костной ткани [22]
Физиологическая регенерация костной ткани.
Физиологическая регенерация имеет следующие стадии: покой, активация, резорбция, реверсия, формирование. На рисунке 3 описаны участвующие в этих стадиях структуры и клетки. Опишем подробно ключевые стадии.
Рисунок 3. Стадии ремоделирования костной ткани
Этапы резорбции.
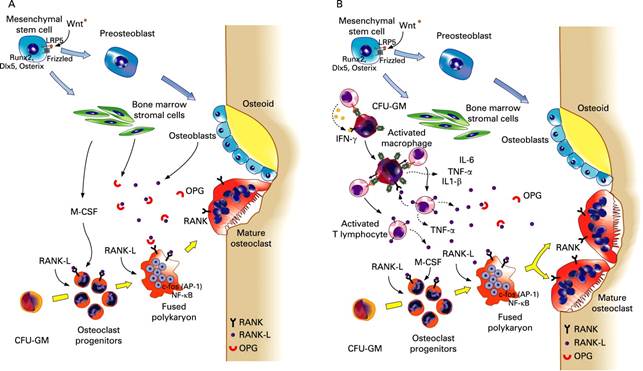
Остеобласты и Т-лимфоциты секретируют лиганды рецепторов активатора фактора нуклеации каппа В (RANKL) и до определённого момента молекулы RANKL могут оставаться связанными с поверхностью остеобластов или стромальных клеток [1]. Из стволовой клетки костного мозга образуются предшественники остеокластов. Они имеют мембранные рецепторы, называемые рецепторами активатора фактора нуклеации каппа В (RANK) [1]. На стадии образования остеокластов из предшественников процесс может блокироваться белком остеопротегерином (OPG), который, свободно перемещаясь, способен связывать RANKL и таким образом предотвращать взаимодействие RANKL с RANK-рецепторами [1]. На следующем этапе RANK-лиганды (RANKL) связываются с RANK- рецепторами, что сопровождается слиянием нескольких предшественников остеокластов в одну крупную структуру и формируются зрелые многоядерные остеокласты [1]. Далее во время процесса адгезии остеокласт прикрепляется к матриксу кости за счёт рецепторов к интегрину и витронектину. После адгезии происходит выделение продуктов внутриклеточного синтеза. В удалении минеральных солей определенная роль принадлежит усиливающейся при остеолизе продукции органических кислот, в том числе лактата. Известно, что сдвиг рН ткани в кислую сторону способствует растворению минералов и тем самым их удалению. Органический матрикс резорбируется глицерофосфотазой, нитрофенилфосфатозой и др. Роль кислых гидролаз в процессах катаболизма органического матрикса заключается во внутриклеточном переваривании фрагментов резорбируемых структур. Далее продукты распада фагоцитируются и подвергаюся дальнейшему распаду. После распада начинается слияние везикул (c продуктами резорбции) с TRAP — содержащими лизосомами и каскад биохимических реакций, приводящих к окончательному распаду органических веществ в лизосомах (Рис. 4):
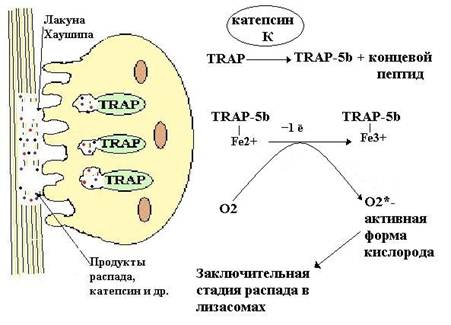
Рисунок 4. Остеокласт и каскад реакций
Реверсия.
Остеокласт, деминерализующий костный матрикс (резорбция), уступает место макрофагам, которые завершают разрушение органической матрицы межклеточного вещества кости и подготавливают поверхность к адгезии остеобластов. Также макрофаги активируют стволовые клетка за счёт различных факторов роста.
Формирование.
Процесс минерализации возможен лишь при наличии строго ориентированных коллагеновых волокон, которые синтезируются остеобластами. Между концом одной молекулы и началом следующей имеется промежуток. Вполне вероятно, что промежутки вдоль ряда молекул тропоколлагена являются первоначальными центрами отложения минеральных солей.
Показано, что при формировании кости в зоне кальцификации при участии лизосомных протеиназ происходит деградация протеогликанов. По мере минерализации костной ткани кристаллы гидроксилапатита как бы вытесняют не только протеогликаны, но и воду.
Щелочная фосфотаза и фосфогидролаза, содержащиеся в матриксных пузырьках (с большим количеством ионов кальция) остеобластов расщепляют глицерофосфаты, в результате образуются фосфат — ионы и органические компоненты. После накопления кальция и фосфора начинается минерализация, заключающаяся в образовании солей фосфата кальция. Также происходит отщепление гликопротеинов от молекул коллагена, после чего гликопротеины связывают ионы кальция. Все эти реакции возможны лишь при достаточном поступлении кислорода к остеобластам.
Следует отметить, что не все коллагенсодержащие ткани в организме подвержены оссификации. По-видимому, существуют специфические ингибиторы кальцификации. Ряд исследователей считают, что процессу минерализации коллагена в коже, сухожилиях, сосудистых стенках препятствует постоянное наличие в этих тканях протеогликанов, а также неорганический пирофосфат. В целом биохимические механизмы минерализации костной ткани требуют дальнейшего исследования.
Репаративная регенерация костной ткани.
При повреждении возникает так называемая предварительная соединительнотканная мозоль, в которой сразу же начинается образование кости. Оно связано с активацией и пролиферацией остеобластов в зоне повреждения, но прежде всего в периосте и эндосте. Появляются малообызвествленные костные балочки, количество которых нарастает. Образуется предварительная костная мозоль [14]. В дальнейшем она созревает и превращается в зрелую пластинчатую кость: так возникает окончательная костная мозоль, которая по своему строению отличается от костной ткани лишь беспорядочным расположением костных перекладин. При появлении статической нагрузки вновь образованная ткань с помощью остеокластов и остеобластов подвергается перестройке, появляется костный мозг, восстанавливаются васкуляризация и иннервация [14].
Восстановление костной ткани происходит за счёт деления клеток камбиального слоя надкостницы, эндоста, малодифференцированных клеток костного мозга и мезенхимальных клеток (адвентиции сосудов).
При нарушении местных условий регенерации кости происходит вторичное костное сращение [14]. Для этого вида сращения характерно образование между костными отломками первоначально хрящевой ткани (хрящ может появиться и в костномозговом канале), на основе которой строится костная ткань. Вторичное костное сращение встречается значительно чаще и занимает больше времени [14].
При инфицировании раны регенерация кости задерживается. Иногда первичная костно-хрящевая мозоль не дифференцируется в костную. В этих случаях концы сломанной кости остаются подвижными, образуется ложный сустав [14].
Избыточная продукция костной ткани в процессе регенерации приводит к появлению костных выростов — экзостозов.
Стадии репаративной регенерации костной ткани.
В процессе регенерации можно выделить 4 основные стадии. Аутолиз — в ответ на развитие травмы развивается отёк, происходит активная миграция лейкоцитов, аутолиз погибших тканей. Достигает максимума к 3—4 дню после перелома, затем постепенно стихает [21]. Пролиферация и дифференцировка — активное размножение клеток костной ткани и активная выработка минеральной части кости. При неблагоприятных условиях сначала формируется хрящевая ткань, которая затем минерализуется и заменяется костной. Перестройка костной ткани — восстанавливается кровоснабжение кости, из костных балок формируется компактное вещество кости [21]. Полное восстановление — восстановление костномозгового канала, ориентация костных балок в соответствии силовыми линиями нагрузки, формирование надкостницы, восстановление функциональных возможностей повреждённого участка [21].
Выделяют 4 вида костной мозоли:
Как реакция на травму, в области перелома развивается асептическое воспаление, экссудация, эмиграция лейкоцитов, что влечет за собой отек тканей вследствие серозного пропитывания. Процесс регенерации костной ткани, в сущности, является одним из видов воспалительного процесса [10].
Регенерация состоит в быстром (24—72 часа) размножении местных клеточных и внеклеточных элементов, образовании первичной костной мозоли (callus). Для образования костной мозоли имеет значение наличие гематомы, так как в процессе регенерации кости большую роль играет внеклеточное живое вещество и трофическая роль нервной системы [10].
Периостальная (наружная) мозоль формируется небольшое утолщение вдоль линии перелома, которое развивается из клеток надкостницы (callus externus) в виде муфты. Главную роль в образовании мозоли играет внутренний слой надкостницы, которая имеет три слоя: а) наружный (адвентицпальный), б) средний (фиброзно-эластический), в) внутренний (камбиальный). Со 2-го дня на месте перелома начинается пролиферация клеток со стороны камбиального слоя. К 3—4-му дню имеется уже большое количество эмбриональных клеток, молодых, вновь образованных сосудов и остеобластов. Они являются главными клетками, образующими новую костную (остеоидную) ткань, т. е. ткань, имеющую строение костной, но еще не обызвествившуюся [10].
Эндостальная (внутренняя) мозоль расположена внутри кости. Развивается параллельно развитию наружной из эндостальной ткани обоих отломков, т. е. из костного мозга; процесс идет путем пролиферации клеток эндоста в виде кольца, спаивающего отломки. Более медленное развитие эндостальной мозоли сравнительно с периостальной объясняется тем, что сосудистая сеть эндостальной мозоли (a. nutritia), которая бедна сосудами, разрушена, в то время как периостальная мозоль снабжена большим количеством сосудов, идущих из окружающих мягких тканей [10].
Интермедиальная, промежуточная, мозоль (callus intermedius) расположена между костными отломками, профиль кости не изменён. Развивается из гаверсовых каналов, причем в образовании ее принимают участие ткани наружной и внутренней мозоли [10].
Параоссальная, околокостная, мозоль (callus paraossalis) окружает кость достаточно крупным выступом, может искажать форму и структуру кости. Развивается в мягких тканях вблизи перелома. Представляется в виде отростков кости, распространяющихся иногда далеко в направлении мышц, межмышечной ткани и в область суставов. Наблюдается часто на месте неправильно сросшихся переломов в виде так называемой избыточной мозоли. Параллельно при помощи остеокластов идет рассасывание концов старой кости, отломков, а затем и избытка вновь образующейся кости [10].
В среднем в течение приблизительно одного месяца идет образование первичной костной мозоли. В течение следующего месяца наступает окостенение мозоли; в остеоидной ткани первичной мозоли откладываются соли извести и уменьшается ее объем. Мозоль приобретает прочность, т. е. образуется вторичная костная мозоль и наступает сращение, консолидация отломков [10].
Фаза функциональной адаптации. В этом периоде заживления костной мозоли происходит обратное развитие сосудов, уменьшение и исчезновение всех симптомов воспаления. В связи с прекращением гиперемии прекращается усиленное кровообращение, изменяется среда (уменьшается ацидоз).
Губчатая кость заменяется на компактную. Постепенно идет архитектурная перестройка участка сращения кости, заключающаяся не только в обратном развитии мозоли, но и в восстановлении облитерированного костномозгового канала, в образовании балок или перекладин соответственно нормальному строению.
Репаративная регенерация костной ткани после огнестрельного перелома
Фаза ранних посттравматических изменений:
· некроза и перинекротическая зона;
· макрофагальная реакция;
· врастание многочисленных пролиферирующих фибробластов.
Фаза регенерации:
· начинается периостальный остеогенез (к концу 1 недели);
· все костные осколки интегрируются в единый костный регенерат;
· тканевый регенерат носит гетероморфный характер, включающий неравномерное расположенные участки ретикулофиброзной костной ткани, гиалиновый хрящевой и волокнистой соединительной ткани (к 30 суткам).
Фаза функциональной адаптации (через 60—90 суток):
· -ремоделирование;
· -начало восстановления костномозгового канала (через 120 суток) и заполнение элементами кроветворного и жирового костного мозга (ещё через 2 месяца).
Локальная регуляция регенерации: белки костного морфогенеза (БКМ) и другие факторы роста.
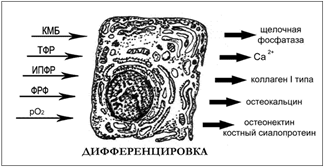
Рисунок 5. Остеогенная клетка
КМБ — костный морфогенетический белок; ТФР — трансформирующий фактор роста, ИПФР — инсулиноподобный фактор роста, ФРФ — фактор роста фибробластов, pO2-парциально давление кислорода (Рис. 5).
Белки костного морфогенеза (БКМ или КМБ, BMP). Они являются мощными факторами остеоиндукции, вызывают митогенез мезенхимальных стволовых клеток (МСК) и их дифференциацию из остеобластов. Есть сведения, что БКМ связывают экстрацеллюлярные компоненты костного матрикса, гепарин и активирует продукцию коллагена, что способствует регенерации кости. С помощью технологии рекомбинантной ДНК, БКМ-2 и БКМ-7 были лицензированы для клинического применения в 2001—2 году. Эти два вещества были использованы в различных клинических условиях, включая несращение, открытые переломы, асептический некроз. В настоящее время выделено около 15 типов БКМ [4, с. 106].
Следует указать, что в организме помимо системы индукции остеогенеза существует и система его подавления. Так недавно описанный белок — OIP-остеогенетический ингибирующий белок является по биологическому действию антагонистом БКМ.
Таблица 1.
Другие факторы, регулирующие процессы регенерации кости [1]
Резорбция |
Остеогенез |
Интерлейкины (повыш. концентрация) ИЛ-1,-3,-4,-6,-8,-11 подавляют рост и дифференцировку клеток, снижают продукцию коллагеназы |
γ-интерферон |
Интегрины (повыш. концентрация) |
Остеопротегирин |
Витамин А (повыш. концентрация) |
Лактоферрин-железосодержащий гликопротеин, который стимулирует пролиферацию и дифференцировку остебластов |
Простгландины E и E2 ускоряют выход ионов Ca2+ из кости, увеличивают генерацию остеокластов
|
Трансформирующий β - фактор роста (TGF- β) |
Эпидермальный фактор роста (PDGF) |
|
Основной и кислотный фактор роста фибробластов (bFGF, aFGF) |
|
1.25-дигидрохолекльциферол ( D3) [16] |
|
TNF (фактор некроза опухоли) [17]
|
Фактор роста эндотелия сосудов |
β-, инсулин - подобный фактор роста-1 и 2 (ИФР-1 и -2, IGF1, IGF2) |
|
M-CSF, GM-CSF( грануломакрофагальный и макрофагальный колониестимулирующий факторы) [17] |
Ретиноиды |
Фактор роста тромбоцитов |
Некоторые факторы были использованы по отдельности или в комбинации в ряде исследований in vitro и in vivo, но пока с противоречивыми результатами (Таблица 1). Значение факторов, ингибирующих лейкемию, атрионатрийуретического пептида и эндотелина в участии остеогенеза ещё мало изучено. Один из современных подходов к улучшению регенерации костей и мягких тканей — это использование обогащенной тромбоцитами плазмы, плазму фракции аутологичной крови с тромбоцитами (в концентрациях выше базового уровня), которые богаты многими из вышеупомянутых молекул.
Нанотехнологии, кажется, перспективны в подходе оптимальной доставки факторов роста в будущем костно-тканевой инженерии. Тем не менее, из-за пробелов в нынешнем понимании этих факторов, пока не удается воспроизвести такую регенерацию in vivo.
Системное улучшение регенерации кости за счёт влияния на метаболизм костной ткани.
1. Гормон роста (ГР). В настоящее время данные свидетельствуют о положительной роли ГР в заживлении переломов, но есть вопросы о его безопасности и оптимальной дозе, при системном введении.
2. В настоящее время два ПТГ (паратирин, паратиреоидный гормон): 1—34 (или teriparitide) и ПТГ 1-84 уже используются в клинической практике в качестве анаболических агентов для лечения остеопороза [11]. Введение больших доз паратирина приводит к гибели остеобластов и остеоцитов.
3. Трийодотиронин блокирует дифференцировку остеогенных клеток и одновременно активирует функциональную деятельность остеобластов. Гормон способен стимулировать секрецию гормонов роста. При гипертиреозе действие обратное.
4. Женские половые гормоны активируют остеобласты, угнетают остеокласты, способствуют всасыванию Ca2+ в кишечнике, стимулируют продукцию кальцитонина щитовидной железой.
5. Бифосфонаты, как известно, уменьшает активность остеокластов, ингибируют резорбцию костной ткани и стимулируют формирование кости, что может быть полезным дополнением к восстановлению кости в качестве антирезорбтивной терапии [11].
6. Дексаметазон необходим недифференцированным клеткам для реализации остеогенных потенций.
7. Применение агонистов рецепторов простагландина EP2 и EP4 [11]. Обнадеживающие результаты были замечены на животных, без побочных эффектов.
8. Глюкокортикоиды в небольших концентрациях способствуют синтезу коллагена, а в больших снижают этот синтез [5].
9. Витамин С. При недостаточности витамина С остеобласты не синтезируют «нормальный» коллаген, что приводит к нарушениям процессов обызвествления костной ткани. Недостаток витамина С вызывает также изменения в синтезе гликозаминогликанов: содержание гиалуроновой кислоты в костной ткани увеличивается в несколько раз, тогда как биосинтез хондроитин-сульфатов замедляется.
10. На развитие кости влияет также витамин А. Но при гипервитаминозе А, наблюдается резорбция кости, что может приводить к переломам.
11. Витамин К. Необходим для синтеза остеокальцина.
12. Витамин Е. При его дефиците в печени не образуется 25(OH)D3; возможно снижение уровня Mg2+ в костной ткани.
Биохимические маркёры метоболизма (регенерации) костной ткани.
Маркёры формирования новой костной ткани:
1. Щелочные фосфатазы (ЩФ).
2. Остеокальцин (ОК).
3. Проколлагеновые пропептиды (АКФ и ККФ).
4. Остеопротегерин (OPG) [13, с. 104—106].
Маркёры резорбции (лизиса) кости:
1. Пиридинолин и дезоксипиридинолин.
2. Тартрарезистентная кислая фосфотаза (TRAP-5b).
3. Коллагеновые телопептиды I типа в плазме и в моче (CTX и NTX).
4. Костный сиалопротеин (BSP) — белок неколлагеновой природы [13, с. 104—106].
По биохимическим показателям можно:
1. При профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования.
2. Оценить и прогнозировать уровень потери костной массы.
3. Быстро оценить эффективность терапии, адекватность дозы препарата.
4. Выбрать наиболее эффективный препарат и определить оптимальный уровень его дозировки индивидуально для каждого пациентах [18].
5. Оценить метаболизм костей при проведении научных исследований.
Применение научных достижений в клинической практике.
1. Дистракционный остеогенез и костный транспорт (техника академика Г.А. Илизарова). Регенерация кости индуцируется между постепенно отдаляющимися поверхностями [8, с. 217].
2. Аутологичные и аллогенные трансплантанты. Среди материалов для костных трансплантатов наибольший интерес вызывает деменерализованный костный матрикс (ДКМ), содержащий протеины, стимулирующие остеогенез [4, c. 105]. Этот материал также обладает способностью к биодеградации (рассасыванию) с замещением костной тканью [4, с. 107].
3. Возможность в будущем применение тканеинженерного эквивалента костной ткани.
4. Существуют мутации генов, например, COL1A1 и СOL1A2, приводящие к коллагенозам и несовершенному остеогенезу [12, с. 701]. Можно попытаться искусственно создать вирус, в геном которого вошли бы нормальные человеческие гены, определяющие структуру поврежденных при патологии белков. Создание искусственных или трансгенных вирусов уже проводились. Таким образом, мы приходим к синтезу генной и вирусной терапии [7].
5. Использование электромагнитного поля [11; 20].
6. Применение костной крошки при травмах черепа.
7. Возможность применения новых методов диагностики и алгоритмов лечения, например, применение селективных модуляторов эстрогеновых рецепторов [3] или тиазидных диуретиков [15], а также назначение физических нагрузок, поскольку достижение определённого уровня физической нагрузки обеспечивает максимальные значения минеральной плотности кости [9, с. 12].
8. Правильное питание. Употребление молочных продуктов принесёт пользу только в случае уменьшения потребления мясных и рыбных продуктов, поскольку избыток белковой пищи приводит к ацидозу, который возможно опосредованно через карбонатный буфер вызывает вымывание кальция из костей [6]. Также не исключёно возникновение ацидоза под влиянием других продуктов рациона питания, например, сахара.
Среди факторов, влияющих на перестройку костной ткани, существенную роль играет так называемый пьезоэлектрический эффект, вызывая в положительно заряженных участках резорбцию, а в отрицательно заряженных—костеобразование (Рис. 6). Но этот эффект не нашёл клинического применения [19].
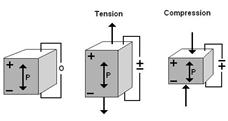
Рисунок 6. Формирование пьезоэлектрического эффекта
Заключение.
Регенерация костной ткани — это совокупность сложных взаимосвязанных процессов, исследование которых позволило разработать новые методы и схемы лечения при нарушениях баланса ремоделирования, например, остеопорозе. В настоящее время требуются дальнейшие исследования молекулярных механизмов перестройки костной ткани, что позволит лучше регулировать биохимические реакции на этапах резорбции и формирования. Также наиболее важно разработать чёткие алгоритмы профилактики, принимая во внимание новые сведения по влиянию питания, гормонов и других факторов на костную ткань.
Список литературы:
1. Вавилова Т.П. Биохимия тканей и жидкостей полостей рта: учебное пособие // 2-е изд., испр. и доп. 2008. — 215.
2. Волков Н.М., Физиология метаболизма костной ткани и механизм развития метастазов в кости // Практическая онкология, № 3-2011, С. 97—102.
3. Зоткин Е.Г., Мазуров В.И. Возможности лекарственной терапии системного остеопороза // Журнал: актуальные проблемы медицины, № 4, 2000.
4. Кирилова И.А. Хирургия позвоночника, 3/2004 (С. 105—110), Деминерализованный костный трансплантант как стимулятор остеогенеза: современные концепции // Новосибирская НИИ травматологии и ортопедии.
5. Кузнецов С.Л., Мушкомбаров Н.Н. Гистология, цитология и эмбриология. Учебник для медицинских вузов // Медицинское информационное агентство. Москва 2005, С. 174.
6. Литвицкий П.Ф. Патофизиология: учебник / — 4-е изд., — 2009. — 496 с. гл.13 Нарушение кислотно-щелочного равновесия.
7. Нуриев Р.И., Сушенцев Н.А., Яковлев В.В. «Регенеративная медицина: обзор» Сборник материалов Международной Биологической Универсиады МГУ им. М.В.Ломоносова — 2013. Изд-во МГУ, 2013.
8. Попков А.В., Осипенко А.В. Регенерация тканей при удлинении конечностей. Руководство для врачей. Москва 2008. — 240 с.
9. Почкайло А.С., Жерносек В.Ф, Диагностика и лечение костной массы и остеопороза у детей // Минск 2010. — 55 с.
10. Руфанов И.Г., «Общая хирургия» // Медгиз, 1953 г.
11. Салеева Д.В. Регенерация кости: клетки и факторы роста. ГБОУ ВПО РНИМУ им. Н.И. Пирогова, Москва, Россия.
12. Северина Е.С., чл.-корр. РАН. Биохимия. Учебник для вузов // 2-е издание, исправленное. Москва. Издательский дом ГЭОТАР-МЕД. 2004.
13. Сергеева Н.С., Тепляков В.В., В.А. Державин, М.П. Солохина, Н.В. Маршутина. Биохимические маркёры ремоделирования костной ткани в онкологии // ОНКОЛОГИЯ. ЖУРНАЛ им. П.А. Герцена, 2, 2012. С. 104—106.
14. Струков А.И. Патологическая анатомия: Учебник. — 4-е изд. — М.: Медицина, 1995. — 688 с.
15. Струков В.И. Актуальные проблемы остеопороза // Пенза: Изд-во «Ростра» — 2009. — 342 с.
16. Silbernagl S., Despopoulos. Color Atlas of Physiology // Thieme. Stuttgart. New York 2012. — Р. 408.
17. Usha Kini, Nandeesh B.N, Physiology of Bone Formation, Remodeling, and Metabolism.
18. Медицинский портал для врачей и студентов: Биохимические маркёры метаболизма костной ткани — [ Электронный ресурс] — Режим доступа. — URL: http://doctorspb.ru/articles.php?article_id=1374 (дата обращения: 12. 08.14).
19. Dommedica.Современная медицина: Пьезоэлектрическая теория формирования костей — [Электронный ресурс] — Режим доступа. — URL: http://dommedika.com/phisiology/1323.html.
20. Скальпель — медицинский информационный портал: Регенерация костной ткани после травматического повреждения — [Электронный ресурс] — Режим доступа. — URL: http://www.skalpil.ru/3562-regeneracii-kostnoy-tkani-posle-travmaticheskogo-povrezhdeniya.html.
21. Словари и энциклопедии «Академик»: Перелом кости — [ Электронный ресурс] — Режим доступа. —URL: http://dic.academic.ru/dic.nsf/ruwiki/670006.
22. Gystology: Bone remodeling — [Электронный ресурс] — Режим доступа. — URL: http://www.siumed.edu/~dking2/ssb/NM006b.htm.