Смешаннолигандные комплексные соединения формиата меди с формамидом и ацетамидом
Конференция: XXXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Неорганическая химия

XXXIV Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Смешаннолигандные комплексные соединения формиата меди с формамидом и ацетамидом
MIXED LIGAND COMPLEX COMPOUNDS OF COPPER FORMATE WITH FORMAMIDE AND ACETAMIDE
Nazocat Yuldasheva
Undergraduate, Urgench State University, Uzbekistan, Urgench
Mukaddas Zhumaniyazova
Doctoral student Urgench State University, Uzbekistan, Urgench
Tokhir Azizov
Professor, Institute of General and Inorganic Chemistry ANRUz, Uzbekistan, Tashkent
Khudoyor Razhabov
Associate Professor, Department of Chemistry, Urgench State University, Uzbekistan, Urgench
Аннотация. Из водного раствора формиата меди, подкисленного муравьиной кислотой, получено смешаннолигандное комплексное соединение с формамидом и ацетамидом в качестве лигандов. Полученное соединение изучали методами фотометрии и потенциометрического титрования, ИК спектроскопии и термогравиметрии.
Abstract. Mixed ligand complex with formamide and acetamide as ligands were obtained from aqueous solutions of copper formate acidified with formic acid. The obtained compound were studied by photometry and potentiometric titration, IR spectroscopy and thermogravimetry.
Ключевые слова: формиаты; комплексные соединения; формамид; ацетамид; фотометрия; потенциометрическое титрование; полоса поглощения; эндоэффект.
Keywords: formats; complex compounds; formamide; acetamide; photometry; potentiometric titration; absorption band; endothermic effect.
В настоящее время активно проводятся работы по получению и исследованию комплексных соединений, обладающих биологически активными свойствами. Широкое применение находят комплексные соединения d-металлов с азотсодержащими лигандами. Соединения ацетамида с некоторыми металлами проявляют высокую биологическую активность при росте растений [1], [2]. Медь относится к жизненно важным элементам. В оптимальных дозах ионы меди оказывают положительное влияние на обмен веществ в организме, предупреждение различных заболеваний животных и человека, а также на повышение роста растений [3]. При отсутствии или недостатке меди в растительных тканях уменьшается содержание хлорофилла, листья желтеют, растение перестаёт плодоносить и может погибнуть. У животных организмов при дефиците меди развивается анемия. Кроме того, соединения меди обладают фунгицидными свойствами [4]. В литературе имеются данные о получении комплексных соединений меди с производными бутилфенола, метилтетразолом и тиомочевиной [5], [6].
Целью нашей работы является получение и исследование строения смешаннолигандного комплексного соединения формиата меди с формамидом и ацетамидом. Для получения нового соединения в муравьинокислый раствор формиата меди, полученный растворением основного карбоната меди (CuOH)2CO3 (марки чда) в избытке 20%-ного раствора муравьиной кислоты добавляли при перемешивании смесь амидов. При этом карбонат гидроксомеди брали в таком количестве, чтобы мольное соотношение реагентов составляло Cu(HCO2)2:HCONH2:CH3CONH2=1:3:3. Реакционную смесь перемешивали около 10 минут и оставляли при комнатной температуре. Через несколько дней из раствора выкристаллизовывается осадок голубого цвета, растворимый в воде. Полученное вещество несколько раз промывали в небольшом количестве дистиллированной воды и сушили при комнатной температуре. При нагревании разлагается. Содержание меди в полученных соединениях определяли дифференциально-фотометрическим методом на фотометре UV – 1800 фирмы Shimadzu, оно составило 21,58% (вычислено 21,63%).
Исследование термической устойчивости металлоамидных комплексов могут дать дополнительную информацию о строении исследуемого соединения.
Термогравиметрический анализ показал, что комплексы содержат кристаллизационную воду, удаление которой происходит в интервале температур 95-1650С с эндоэффектом. Выгорание органической части соединений начинается с отщепления ацетамида при температуре 165-170 0С, формамид отщепляется в интервале температур 190-200 0С.
Для установления индивидуальности соединений получали ИК-спектры их поглощения записывали в области 400-4000 см-1 на спектрометре IRTraser – 100 фирмы «Shimadzu». Значения частот в ИК спектрах формамида, ацетамида и полученных комплексов приведены в таблице 2.
Таблица 2.
Основные частоты поглощения (см-1) в ИК спектрах формамида, ацетамида и смешанноамидного комплекса формиата меди
|
HCONH2 |
СН3CОNH2 |
Cu(HCOO)2‧НCONH2‧ ‧СН3CОNH2‧2H2O |
Отнесение |
|
3450 |
3387 |
- |
ν(NH2) |
|
|
3194 |
- |
2δ(NH2) |
|
1709 |
1670 |
1695,10 |
ν(C=O) |
|
1309 |
1395 |
1369,37 |
ν(CN) |
|
760 |
582 |
582,19 |
δ(NCO) |
|
|
|
3386,87 |
ν(OН) |
|
|
|
1578,55 |
ν(COO) |
Сравнение ИК спектров свободных формамида, ацетамида и полученных комплексов показало, что частоты колебаний карбонильной группы ν(С=О) понижаются на 14 см-1 (Рисунок 1). Вместе с тем наблюдается повышение частот колебаний группы C−N на 56 см-1. Это свидетельствует о координации формамида и ацетамида через атом кислорода карбонильной группы. Валентным колебаниям группы –NH2 в спектре свободного формамида соответствуют полосы поглощения при 3450 см-1, а в спектре ацетамида – 3387 см-1, но в спектре полученного комплекса эти полосы перекрыты полосами колебаний воды 3200-3600 см-1. Вода, по-видимому, входит во внутреннюю сферу координационного соединения, об этом свидетельствует смещение полосы поглощения колебаний воды (ν(OН) = 3656,65см-1) в низкочастотную область – 3386,87 см-1. Полосы поглощения формиатной группы в спектрах координационного соединения позволяют предположить, что формиат-ионы входят во внутреннюю сферу комплекса.
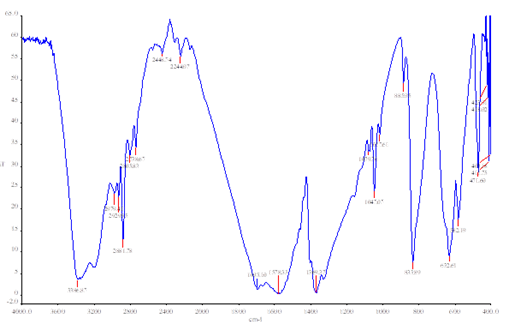
Рисунок 1. ИК спектр комплекса Cu(HCOО)2‧HCОNH2‧CH3СONH2‧2H2O
На основании проведенных исследований полученным комплексам предложена брутто-формула Cu(HCO2)2‧CH3CONH2‧HCONH2‧2H2O.


