Современные проблемы регенерации тимуса
Конференция: XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Клеточная биология, цитология, гистология

XX Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Современные проблемы регенерации тимуса
Аннотация. Рассмотрены вопросы регенерации тимуса. Установлено, что исследования вопроса регенерации вилочковой железы имеет огромное значение в лечении многих заболеваний: различных онкологий; ВИЧ; аутоиммунных заболеваний; патологических состояний самого тимуса и других не менее серьёзных заболеваний.
Ключевые слова: тимус; регенерация.
Тимус, вилочковая или зобная железа – это центральный орган лимфопоэза и имунногенеза. Из костномозговых предшественников Т‑лимфоцитов в нём происходит антигеннезависимая дифференцировка в Т-лимфоциты, разновидности которых осуществляют реакции клеточного иммунитета и регулирует реакции гуморального иммунитета. Вилочковая железа имеет и эндокринную функцию, секретируя тимопоэтины, тимозин и лимфостимулирующий гормон. Тимус находится в верхнем средостении, состоит из двух долек покрытых капсульной тканью и имеет дольчатую структуру, где в каждой дольке различают корковое и мозговое вещества. В основе лежит эпителиальная ткань, состоящая из отростчатых эпителиоретикулоцитов.
Величина железы с возрастом изменяется. У новорождённых примерно 12 г и продолжает нарастать после рождения до наступления половой зрелости достигая 35-40 г, после чего в 14-15 лет начинается инволюция в жировую ткань вследствие, которого масса у 25-летних уменьшается до 25 г, 60 годам становится менее 15 г, к 70 – около 6 г и утрачивает свои важнейшие функции.
Стоит отметить, что при тимоэктомии у новорождённых вызывается резкое угнетение пролифирации лимфоцитов во всех лимфатических узелках кроветворных органов, исчезновение малых лимфоцитов из крови, резкое уменьшение лейкоцитов, атрофия органов, кровоизлияния. При этом организм оказывается весьма чувствительным ко многим инфекционным заболеваниям, но не отторгает чужеродные трансплантаты органов.
В тимусе происходит его физиологическая регенерация, которая осуществляется посредством появления новых лимфоцитов, но до определённого момента. На 7-8-й неделе постэмбрионального развития его эпителий начинает заселяться стволовыми клетками крови, которые дифференцируются в лимфоциты вилочковой железы. Увеличивающееся число лимфоцитов тимуса дает начало T-лимфоцитам, заселяющим T‑зоны периферических органов иммунопоэза. Также происходит восстановление эпителиоретикулоцитов. Теперь рассмотрим более детально все перечисленные выше процессы.
До недавнего времени считали, что в строме тимуса имеется два типа длинно-отростчатых клеток – дендритные и интердигитирующие, которые образуются из моноцитов, способные представлять антигены, не указывая, каким клеткам и какие антигены они представляют. Ныне установлено, что дендритные клетки человека происходят из предшественников, содержащихся в костном мозге. Они обнаруживаются и в циркулирующей крови, дают начало образованию дендритных клеток в различных органах. Из предшественников миелоидного ряда образуются клетки Лангерганса и интерстициальные дендритные клетки, а из лимфоидного предшественника – тимические дендритные клетки. Тимические дендритные клетки мозгового вещества представляют собственные антигены в комплексе с молекулами главного комплекса гистосовместимости I и II аутореактивным тимоцитам. Последние своими Fas-рецепторами связывают массивные дозы аутоантигенов, что вызывает апоптоз Т-клеток или анергию. Этот процесс назван отрицательной селекцией Т-лимфоцитов, он обеспечивает центральную иммунотолерантность.
Установлено, что дендритные клетки, родственные тимическим, образуются в Т-зонах периферических органов лимфопоэза. Они представляют Т-лимфоцитам аутоантигены, не поступающие в вилочковую железу, и обеспечивают периферическую иммунотолерантность. Развитие Т-лимфоцитов обеспечивается совокупностью стромальных клеток тимуса. Претимоциты, реагируя на хемокины из зобной железы и паратирин, выходят из костного мозга в кровь и поступают в тимус на кортикомедуллярной границе. Далее они постоянно мигрируют, вступая в контакты с различными клетками стромы. Контакты генерируют сигналы, вызывающие транскрипцию определенных генов Т-клеток, что приводит к последовательным изменениям их фенотипа с экспрессией антигенов дифференцировки, рецепторов, адгезивных и других молекул. Вышедшие из крови претимоциты в мозговом веществе взаимодействуют со стромальными клетками подтипа V CAM – 1, в результате чего их фенотип изменяется с дважды негативного (DN) CD4-CD8- на дважды позитивный (DP) CD4+CD8+. Через 14 суток после этого DP-клетки обнаруживаются в наружной коре в контакте с клетками стромы, имеют вид крупных делящихся лимфобластов.
Перейдём к гистогенезу и регенерации тканей, здесь у лимфобластов появляются Т-клеточные рецепторы (ТКР). Через 3–5 дней после миграции в наружную кору в популяции DP-клеток образуется очень большое количество (> 108) ТКР-специфичных клонов, каждый из которых может связывать только один определенный антиген. Эти тимоциты переходят в глубокую кору, где встречаются с клетками стромы особого типа, содержащими большое количество продуктов главного комплекса гистосовместимости, тимоциты могут взаимодействовать с его молекулами I или II класса. В первом случае они дифференцируются в однопозитивные CD4-CD8+ предшественники Т‑киллеров или супрессоров, а во втором в CD4+CD8- Т-хелперов. Т‑клетки, не способные связаться с антигенами главного комплекса гистосовместимости («своего»), уничтожаются. Это – положительная селекция Т-лимфоцитов, в осуществлении которой главную роль играют клетки-няньки. Поэтому в контакте с ними должны побывать все тимоциты, способные связаться с молекулами главного комплекса гистосовместимости и получить сигнал на выживание. Этим, вероятно, объясняется закономерное выявление на телах клеток-нянек десятков Т-лимфоцитов. Клетки, прошедшие положительную селекцию, мигрируют в мозговое вещество, где подвергаются отрицательной селекции, после чего выжившие клетки покидают тимус.
Так как тимус легко повреждается различными патогенными факторами, что отражается на состоянии иммунной системы, то он способен к репаративной регенерации, но не такой выраженной как ткани многих других органов. Патогенные факторы могут быть различными, которые способны сформировать следующие нозологические единицы: синдром MEDAC, синдром Ди Джоржи, Т-клеточная лимфома, тимома. К формированию данных заболеваний могут приводить различные эндо- и экзоинтоксикации, влияние различных тератогенов, различные стрессы.
В качестве примера можно привести опыт, в котором в целях изучения микроструктурных изменений тимуса, обусловленных стрессом. Микропрепараты готовили общепринятыми методами из замороженных срезов толщиной 4 мкм. На рисунках 1, 2 в качестве контроля приведены микрофотографии срезов тимуса.
При изучении гистологического строения тимуса мы четко можем визуализировать корковую его часть и собственно мозговой слой (Рисунок 1). Можем увидеть мозговое вещество тимуса, где лимфоцитов мало, видны эпителиоретикулярные клетки, связанные друг с другом отростками (Рисунок 2).
Результаты исследования показали, что после стресса корковое и мозговое вещество долек выглядит одинаково: в них почти отсутствуют лимфоциты, а количество эпителиоретикулоцитов и тучных клеток резко увеличено (Рисунок 3, 4), очевидно, в результате их размножения. В популяции эпителиоретикулоцитов часть клеток окрашена слабооксифильно, остальные – слабобазофильно, а в интактном тимусе все клетки окрашиваются умеренно оксифильно. Нарушено взаиморасположение эпителиоретикулоцитов: большинство клеток образуют сеть, а остальные лежат компактными скоплениями в виде розеток.
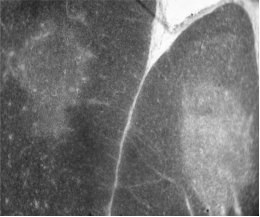
Рисунок 1. Дольки интактного тимуса
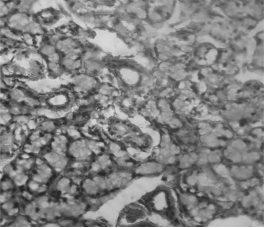
Рисунок 2. Мозговое вещество тимуса

Рисунок 3. Долька тимуса после стресса

Рисунок 4. Дольки тимуса после стресса
Через 30 суток после стресса изменения в строме тимуса усугубились. Появились скопления эпителиоретикулоцитов не только в виде розеток, но и наподобие балок и трубочек, в составе которых имелись деградирующие клетки с уплотненным ядром. Местами в этих структурах отмечался распад клеток и образование пустот (Рисунок 5). Наряду с этим в строме имеется значительное количество эпителиоретикулоциов нормального вида.

Рисунок 5. Дольки тимуса через 30 дней
Подведя итоги можно сказать, что сильный стресс, интоксикация и другие патогенные факторы вызывают опустошение тимуса лимфоцитами, нарушение его стромы и потерю функции. Из этого следует, что современный уровень науки позволяет проводить исследования в целях разработки способов восстановления структуры и функции поврежденного тимуса.
Теперь перейдём к эндогенной регенерации тимуса, позволяющая восстановить иммунитет после стресса, инфекционных заболеваний и других воздействий, истощающих ресурс иммуноцитов. Механизмы, управляющие этой регенерацией, остаются малоизученными.
Однако, в ходе исследований механизма эндогенной регенерации тимуса было обнаружено, что в его основе лежит действие интерлейкина-22 (IL-22), а сигналом к началу его работы служит истощение CD4(+)CD8(+) тимоцитов. В экспериментах было выявлено, что после инсульта тимуса возрастает содержание IL-22. У мышей с дефицитом IL-22 восстановление тимуса было в значительной мере снижено. Введение IL-22 усиливало регенерацию тимуса после тотального радиоактивного облучения. Было показано, что IL-22 действует главным образом на эпителиоретикулоциты тимуса, стимулируя их пролиферацию и повышая их выживаемость при повреждающих воздействиях. Экспрессия IL-22 после повреждения тимуса повышается в устойчивых к радиоактивному облучению RORγ(t)(+)CCR6(+)NKp46(-) клетках-индукторах лимфоидной ткани, что регулируется IL-23.
Таким образом, в данной работе открыт механизм эндогенного восстановления тимуса, что дает основу для разработки новых способов регенеративной медицины для улучшения функции иммунной системы.
Хотелось бы уделить внимание процессу динамики субпопуляций тимоцитов при регенерации тимуса после облучения. Провели исследование в динамике восстановления популяций и субпопуляций тимуса мышей после общего γ-облучения в дозе 4 гр. В наибольшей степени ионизирующей радиацией поражается популяция кортикальных CD4+CD8+-тимоцитов, в результате чего изменяется соотношение клеток различных стадий развития в период максимального опустошения органа (на 5-е сутки). Затем общая численность тимоцитов и практически повторяющая ее численность CD4+CD8+-клеток восстанавливаются с двухволновой кинетикой: к 10-м суткам достигается экстренное восстановление, за которым следует вторичная атрофия с минимальным содержанием клеток на 20-е сутки, после чего реализуется окончательное восстановление.
Двухволновая кинетика, выраженная менее отчетливо, характерна для всех фракций тимоцитов, кроме двух субпопуляций CD-CD8 –клеток – DN2 (CD44+CD25+) и DN3 (CD44-CD25+). Вероятно, эти субпопуляции служат источником экстренного восстановления, и их истощение является причиной вторичной атрофии. Для периодов опустошения тимуса под прямым влиянием облучения (на 5-е сутки) и на пике вторичной атрофии (на 20-е сутки) характерно снижение соотношения тимоцитов, слабо и сильно экспрессирующих рецепторный комплекс CD3-TCR (CD3lo/CD3hi). Это изменение проявляется также на 60-е сутки после облучения, что рассматривается как ранний признак лучевого старения тимуса.
Вернёмся к инволюции тимуса. Его обратное развитие сопровождается уменьшением количества лимфоцитов, особенно в корковом веществе, появление липидных включений в соединительнотканных клетках и развитием жировой ткани. В редких случаях тимус не претерпевает возрастной инволюции. Вследствие всего перечисленного тимус утрачивает в конечном итоге функцию лимфоцитопоэза и иммуногенеза. Поэтому проблема восстановления функций зобной железы очень актуальна. Данный вопрос способствовал появлению нового метода регенерации инволюционированного тимуса. В ходе эксперимента был увеличен в организме подопытного животного уровень белка FOXN1, вырабатываемого клетками тимуса. Благодаря данному белку происходит активация и деактивация генов, ответственных за контроль развития органа. Повышение концентрации FOXN1 «перезапустила» клетки тимуса у подопытных животных, чей возраст можно сопоставить с пожилым возрастом человека. Тимус регенерировался и вновь приобрел структуру и размеры сопоставимые с тимусом молодых особей. Однако, помимо регенерации своего размера, тимус восстановил возможность производства клеток Т-типа, что является основной функцией органа. Несомненно, подобный эксперимент позитивно скажется на развитии медицины в целом и в будущем даст необходимые данные для помощи больным людям, чьи заболевания связаны с нарушениями работы иммунной системы. Следует отметить, что, несмотря на столь большой скачок в развитии регенеративной медицины, пока, к сожалению, нет возможности выращивать новые органы внутри людей так как, анатомия человека намного сложнее, чем испытуемых животных. Данный эксперимент показал на сколько перспективна и многообещающа отрасль регенеративной медицины.
В заключении можно сказать, что рассмотрение вопроса регенерации тимуса имеет огромное значение в лечении многих заболеваний, развитие этих исследований внесет величайший вклад прежде всего в лечение различных онкологий, ВИЧ, аутоиммунных заболеваний, патологических состояний самого тимуса и других не менее серьёзных заболеваний.


