Мультикомпонентный синтез новых производных койевой кислоты
Конференция: VIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Органическая химия

VIII Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Мультикомпонентный синтез новых производных койевой кислоты
Multicomponent synthesis of new derivatives of kojic acid
Yulia Anisina
PhD student, N.D. Zelinsky Institute of Organic Chemistry Russian Academy of Sciences, Russia, Moscow
Stepan Krymov
Student, D. Mendeleev University of Chemical Technology of Russia, Russia, Moscow
Аннотация. Каталитическая мультикомпонентная реакция салициловых альдегидов, малононитрила и койевой кислоты, инициированная ацетатом натрия и кипячением в этаноле приводит к быстрому (1 час) и эффективному образованию замещенных 2-амино-4Н-хромен-3-карбонитрилов с 71-96% выходами. Разработанный быстрый каскадный подход к замещенным 4Н-хроменам, которые известны как лекарственные вещества с, антибиотической, противовоспалительной и противоопухолевой активностью, является выгодным, с точки зрения ориентированных на разнообразие крупномасштабных процессов, и представляет собой быструю, эффективную и экологически безопасную синтетическую концепцию для стратегии каскадных реакций.
Abstract. Сatalytic multicomponent reaction of salicylaldehydes, malononitrile and kojic acid initiated by sodium acetate and reflux in ethanol results in the fast (1 hour) and efficient formation of substituted 2-amino-4H-chromene-3-carbonitriles in 71–96% yields. The developed fast cascade approach to the substituted 4Н- chromenes, which are known as medicinally relevant substances with, antibiotic, anti-inflammatory and anti-cancer activity, is beneficial from the viewpoint of diversity-oriented large-scale processes and represents fast, efficient and environmentally benign synthetic concept for cascade reactions strategy.
Ключевые слова: мультикомпонентные реакции; койевая кислота; хромены.
Keywords: multicomponent reactions; kojic acid; chromenes.
1. Введение
Стратегия синтеза с применением мультикомпонентных реакций обладает существенным преимуществом в сравнении с классическим многостадийным методом, благодаря гибкости, воспроизводимости и соответствии принципу «экономии атомов» [1]. Таким образом, наибольший интерес к данному типу реакций вызван снижением затрат энергии и растворителей, а также, соответствия принципам «зеленой химии» [2].
Хроменовая система является важным фармакофорным фрагментом, ответственными за проявление разнообразной биологической активности, например, антибактериальной, цитотоксической, противогрибковой и противовоспалительной (1), (2) (рисунок 1) [3].

Рисунок 1. Хроменовая система
Механизм действия этих соединений основан на апоптозе злокачественных клеток, вызванный ингибированием связывания тубулина с сайтом связывания колхицина [4].
Койевая кислота (3) (рисунок 2), являясь грибковым метаболитом, была широко изучена в качестве ингибитора тирозиназы [5]. Тирозиназа играет важную роль в биосинтезе меланина из тирозина. Этим объясняется применение койевой кислоты в косметологии в качестве осветляющего агента, а также в пищевой отрасли в качестве добавки, не допускающей гниения [6].

Рисунок 2. Койевая кислота
Именно поэтому мультикомпонентный синтез 2-амино-4Н-хромен-3-карбонитрилов, содержащих фрагмент койевой кислоты, представляется интересным и перспективным.
2. Обсуждение результатов
Нами установлено, что реакция салициловых альдегидов 1a-j, малононитрила и койевой кислоты приводит к образованию 2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрилов 2a-j (схема 1).
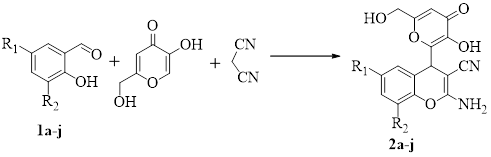
Схема 1. реакция салициловых альдегидов 1a-j, малононитрила и койевой кислоты
В ходе работы была проведена оптимизация условий реакций. Выход целевого соединения в реакциях, проводимых без катализатора в этаноле и воде при комнатной температуре, по ЯМР составила лишь 51% и 35 % соответственно. Продуктом реакции, при проведении реакции в 5 мл этанола, в течение часа при кипячении в присутствии 10 мол.% AcONa, является 2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрил (2а) с выходом 96%. Иное время проведения реакции, а также изменение количества ацетата натрия или же применение альтернативных катализаторов приводили к снижению выхода реакции (таблица 1).
Таблица 1.
|
Катализатор |
Кол-во кат., мол.% |
Р-ль, мл |
Время, ч |
Темп.,оС |
Выход,% |
|
- |
- |
EtOH, 5 |
2 |
20 |
51[b] |
|
- |
- |
H2O, 20 |
2 |
20 |
35[b] |
|
- |
- |
H2O, 20 |
4 |
20 |
50 [b] |
|
AcONa |
10 |
EtOH, 5 |
2 |
78 |
66[b] |
|
AcONa |
10 |
EtOH, 5 |
1 |
78 |
96 |
|
AcONa |
10 |
EtOH, 5 |
0,5 |
78 |
86 |
|
AcONa |
20 |
EtOH, 5 |
1 |
78 |
89 |
|
- |
- |
H2O, 20 |
1 |
50 |
72 |
|
Et3N |
10 |
EtOH, 5 |
1 |
78 |
71 |
|
KF |
10 |
EtOH, 5 |
1 |
78 |
66 |
Примечание: [a]Койевая кислота 3 ммоль, салициловый альдегид 3ммоль, малононитрил 3 ммоль [b]Выход по ЯМР.
В оптимальных условиях (5 мл EtOH, 10 мол.%AcONa, 78°C, 1 час) осуществлены мультикомпонентные трансформации салициловых альдегидов, малононитрила и койевой кислоты в замещенные 2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрилы с высокими выходами 71-96% (таблица 2). Чистые соединения выделяли простым фильтрованием, затем промывали ледяным метанолом, высушивали. В редких случаях требовалась перекристаллизация из ТГФ.
Таблица 2.
|
Соединение |
R1 |
R2 |
Выход,% |
|
2a |
H |
H |
96 |
|
2b |
Me |
H |
91 |
|
2c |
H |
OMe |
86 |
|
2d |
Br |
OMe |
79 |
|
2e |
Cl |
H |
75 |
|
2f |
Br |
H |
79 |
|
2g |
Cl |
Cl |
78 |
|
2h |
Br |
Br |
76 |
|
2i |
NO2 |
H |
75 |
|
2g |
2-гидроксинафтальдегид |
71 |
|
Чистота и строение полученных соединений были подтверждены спектральными методами анализа.
3. Общая методика синтеза

В круглодонную одногорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и обратным холодильником, помещают 5 мл этанола, 3 ммоль салицилового альдегида, 3 ммоль малононитрила, и 3 ммоль койевой кислоты, затем к раствору добавляют 0,3 ммоль ацетата натрия. Смесь перемешивают в течение 1 ч при кипячении. Выпавший осадок отфильтровывают, промывают ледяным метанолом, высушивают в вакууме водоструйного насоса, при необходимости кристаллизуют из тетрагидрофурана.
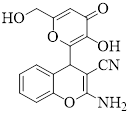 2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрил(2-a), выход 96%, т. пл. 254-255 °С.
2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрил(2-a), выход 96%, т. пл. 254-255 °С.
1HЯМР (DMSO-d6): δ 4.15 (тдд, J = 15.7, 5.5 Гц, 2Н, СН2), 5.20 (с, 1H, CH), 5.58 (т, J = 5.87 Гц, 1H, OH),6.29 (с, 1H, CH), 7.06-7.32 (м,6Н, NH2, Ar),9.21 (уш. с, 1H, OH) ppm.
13C ЯМР (DMSO-d6): δ 34.5, 51.0, 59.9, 109.4, 116.7, 119.9, 120.4, 125.4, 128.7, 129.5, 141.9, 149.4, 150.9, 162.0, 168.0, 174.2 ppm.
MS (70 эВ): m/z (относительная интенсивность): 312 (52, M+), 295 (4), 228 (100), 171 (17), 228 (100), 31 (10), 26 (4), 17(8), 16 (16).
ИК (KBr):1075, 1279, 1459, 1490, 1654, 2193, 3086, 3310, 3362, 3658 cm-1.
4. Заключение
В результате работы были получены новые 2-амино-4-(3-гидрокси-6-(гидроксиметил)-4-оксо-4H-пиран-2-ил)-4H-хромен-3-карбонитрилы путем мультикомпонентной реакции. Отличительной чертой предложенного метода является прямое получение гетероциклических соединений, а также, соответствие принципам «зеленой химии».


