ИЗУЧЕНИЕ ПРИМЕНИМОСТИ НЕКОТОРЫХ ПРОИЗВОДНЫХ ПИРИДИНА И ПИРИМИДИНА КАК ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ ДЛЯ ОКРАШИВАНИЯ КУЛЬТУР КЛЕТОК
Конференция: LXXVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
Секция: Медицинская химия

LXXVI Международная научно-практическая конференция «Научный форум: медицина, биология и химия»
ИЗУЧЕНИЕ ПРИМЕНИМОСТИ НЕКОТОРЫХ ПРОИЗВОДНЫХ ПИРИДИНА И ПИРИМИДИНА КАК ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ ДЛЯ ОКРАШИВАНИЯ КУЛЬТУР КЛЕТОК
STUDY OF THE USE OF SOME PYRIDINE AND PYRIMIDINE DERIVATIVES AS FLUORESCENT PROBES FOR STAINING CULTURED CELLS
Natalia Verbitskaya
Student, Ural Federal University named after the first President of Russia B.N. Yeltsin, Russia, Yekaterinburg
Artem Minin
Assistant, Ural Federal University named after the first President of Russia B.N. Yeltsin, Russia, Yekaterinburg
Egor Verbitsky
Doctor of Chemical Sciences, Professor of the Russian Academy of Sciences, I.Ya. Postovsky Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences, Russia, Yekaterinburg
Финансовая поддержка
Работы по синтезу соединений выполнены при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № 124020500039-0 «Новые синтетические подходы к высокотехнологичным материалам, в том числе для технологии органического синтеза и электроники»).
Аннотация. При разработке флуоресцентных зондов, нацеленных на органеллы, наиболее часто используется химическая маркировка молекул, так как они универсальны и относительно недорогие в производстве. Разработка оптических зондов поможет обеспечить понимание функции органелл в физиологических и патологических процессах. В статье приводятся некоторые производные пиридина и пиримидина в качестве визуализации липидных капель.
Abstract. In developing fluorescent probes targeting organelles, chemical labeling of molecules is most often used, as they are versatile and relatively inexpensive to produce. The development of optical probes will help to understand the function of organelles in physiological and pathological processes. The article presents some pyridine and pyrimidine derivatives as visualization of lipid droplets.
Ключевые слова: пиридин, пиримидин, липидные капли, флуоресцентный зонд.
Keywords: pyridine; pyrimidine; lipid droplet; fluorescent probe
Липидные капли – это клеточные органеллы, которые накапливают липиды и состоят из фосфолипидного монослоя и нейтрального липидного ядра, которое содержит триглицериды и эфир холестерина [7]. Образование липидных капель происходит в эндоплазматическом ретикулуме как высокодинамичный процесс [4]. Данные органеллы играют одну из важнейших ролей в поддержании нормальной жизнедеятельности клеток [9]. Различные патологические состояния человеческого организма, такие как: ожирение [13], неалкогольная жировая болезнь печени [12], атеросклероз [2], тесно связаны с накоплением липидных капель. Поэтому быстрая и своевременная диагностика изменений, связанных с липидными каплями, очень важна для понимания физиологических процессов в клетках, а также для разработки соответствующих терапевтических стратегий.
Флуоресцентная визуализация, направленная на мониторинг биологических функций липидных капель, продемонстрировала большой потенциал в последнее время благодаря применению в реальном времени, превосходной чувствительности, и высокому отношению сигнал/шум [2], [6].
Исследуемы вещества основе CF3-замещенных пиридинов (1а-е) пиримидинов (2а-е) были синтезированы в ФГБУН Институте органического синтеза им. И. Я. Постовского УрО РАН.
Основная идея разработки зонда, меченного химическими молекулами, заключается в ковалентном связывании флуоресцентного зонда с подходящим органеллоцелевым блоком [6]. Свойства молекулы зонда (например, липофильность, гидрофильность, pKa и плотность заряда) являются ключевыми факторами, влияющими на проницаемость клеток и способность к таргетингу [1]. Поэтому при разработке органеллоцелевых зондов необходимо учитывать эти факторы.
В таблице 1 представлены химические свойства исследуемых веществ. Из группы пиридинов наибольшее значение lgP имеет соединение 1а, а наименьшее 1d, а в группе пиримидинов наибольшее значение имеет соединение 2a, а наименьшее 2d. Таким образом, наибольшей липофильностью обладают вещества 1а и 2a. Следовательно, можно предположить, что они будут накапливаться в лиофильных структурах, таких как липидные капли, эндоплазматический ретикулум.
Таблица 1.
Химические характеристики исследуемых веществ
|
Шифр соединения |
Молекулярная формула |
Молекулярная масс, g/mol |
lgP |
|
Пиридины |
|||
|
1a |
C33H25F3N4 |
534.57 |
7.00 |
|
1b |
C33H23F3N4 |
532.56 |
6.87 |
|
1c |
C29H23F3N4 |
484.51 |
6.07 |
|
1d |
C21H15F4N3 |
385.36 |
4.97 |
|
1e |
C22H15F6N3 |
435.37 |
5.69 |
|
Пиримидины |
|||
|
2a |
C31H25F3N4 |
510.55 |
6.85 |
|
2b |
C31H23F3N4 |
508.54 |
6.74 |
|
2c |
C27H23F3N4 |
460.49 |
5.90 |
|
2d |
C19H15F4N3 |
361.34 |
4.75 |
|
2e |
C20H15F6N3 |
411.34 |
5.49 |
Эксперименты на клеточных культурах проводились с использованием культур RD (клетки эмбриональной рабдомиосаркомы человека) и Vero (клетки эпителия почки зеленой мартышки), полученные из российской коллекции клеточных культур Института цитологии РАН (г. Санкт-Петербург). Для культивирования перевиваемых клеточных линий в качестве основной среды использовали полусинтетическую питательную среду DMEM (BioinnLabs, Россия) с добавлением 10% фетальной бычьей сыворотки (Biolot, Россия). Культивирование клеток происходило в инкубаторе при температуре 37 °С и атмосфере, содержащей 5% углекислого газа. Перед проведение экспериментов клетки были протестированы на отсутствие микоплазмы. Все манипуляции с растворами веществ и, в дальнейшем, с клетками проводились в ламинарном боксе Bioinnelix (BioinnLabs, Russia) при красной подсветке (625 нм) для минимизации воздействия на вещества светом.
Перед проведением экспериментов на культурах клеток с потенциальными флуоресцентными зондами, мы провели резазуриновый тест [8] с использованием живых клеток Vero для оценки цитотоксичности. Жизнеспособность клеток оценивали путем инкубации клеток с различными концентрациями зондов (0, 10-2, 10-4, 10-6, 10-8 М).
Для исследования клетки рассевались в 96 луночный планшет (JetBiofil, China) и доращивались до 70% монослоя, после чего среда отбиралась многоканальным дозатором и замещалась на приготовленную среду с добавлением исследуемого вещества. После 48-часовой инкубации с веществами в лунки планшета добавляли раствор резазурина (Thermo Scientific, США) в концентрации 0,42 мМ в количестве 20 мкл на лунку. Из угловых лунок удаляли среду и добавляли ДМСО на 5 минут для уничтожения клеток, и использования этих лунок в качестве бланков. Затем ДМСО удаляли, лунки промывали фосфатным буфером и заливали в них свежую среду в объеме, соответствующем остальным лункам. Для регистрации интенсивности флуоресценции в трех диапазонах спектра использовали Chemidoc MP (Biorad, США): Green Epi с зеленым фильтром 605/50 для измерения интенсивности резафурина, Red Epi с
фильтром 695/55 для ресазурина и Blue Epi с фильтром 530/28 для получения изображения самого планшета. Полученные изображения обрабатывали с помощью программы CellProfiler(4.2.5) [10] для сегментации ячеек планшета и измерения интенсивности флуоресценции каждой из них. Испытания показали, что выживаемость клеток линии Vero, культивируемых с флуорофорами 1 и 2 в течении 48 часов, превышает 90% даже при самой высокой концентрации 10-2 М флуорофоров (рисунок 1). Это результаты демонстрируют низкую биотоксичность и предполагают, что эти соединения могут быть практическим инструментом для маркировки клеточных органелл в сложных биологических средах.
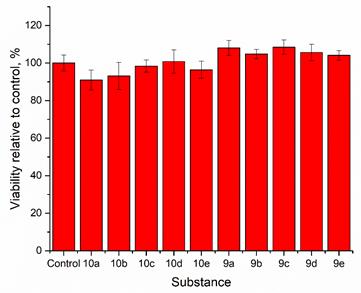
Рисунок 1. Результаты резазуринового теста (процент выживаемости клеток линии Vero) для соединений 9 a-d и 10 a-d (С= 10-2 М в ДМСО/питательной среде) с чистой питательной средой в качестве положительного контроля
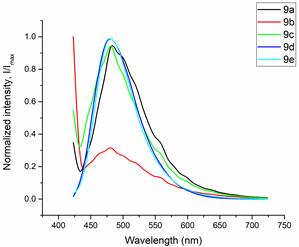
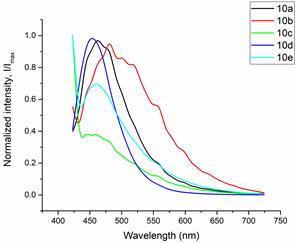
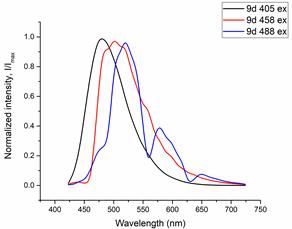
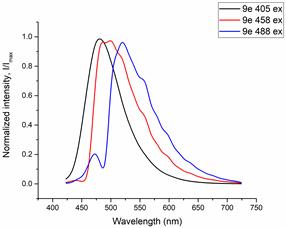
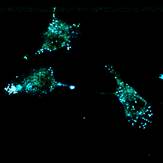
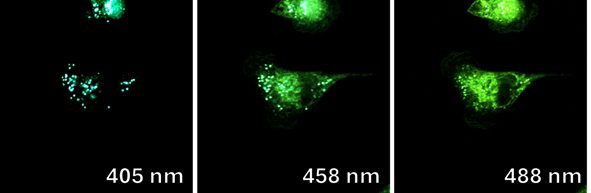
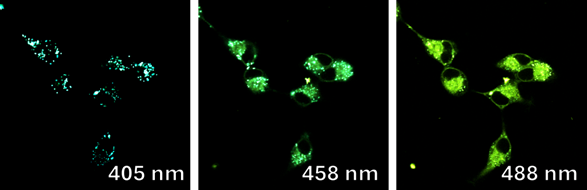
Оценку клеточной проницаемости и внутриклеточной локализации проводилось с использованием клеточной культуры RD (клетки эмбриональной рабдомиосаркомы человека) полученных из российской коллекции клеточных культур Института цитологии РАН. Распределение соединений 1a-e и 2a-e изучалось с использованием лазерного сканирующего конфокального микроскопа LSM-710 (Carl Zeiss, Germany). Клетки культуры RD инкубировались с соединениями 1 и 2 в течение 0,5 часа (рабочая концентрация флуорофоров 10-5 М). Исследованные соединения облучались лазерами с длинами волн 405, 458, и 488 нм. Спектры испускания веществ были извлечены из изображений, полученных в лямбда-режиме (рисунок 2 и 3).
|
(a) |
(b) |
|
|
|
Рисунок 2. Спектры флуоресценции клеток культуры RD, окрашенных красителями (a) 1a-e и (b) 2a-e.
|
(a) |
(b) |
|
|
|
Рисунок 3. Спектры флуоресценции клеток культуры RD, окрашенных красителями 1d (a) и 1e (b) при возбуждении 405 нм, 458 нм, 488 нм, соответственно
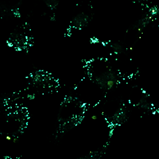
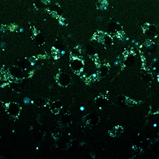
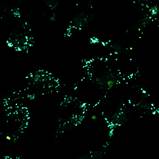
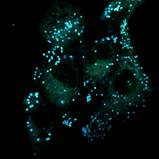
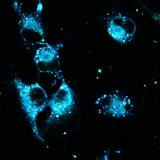
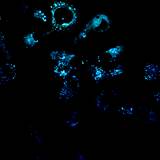
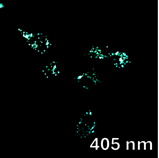
Важно отметить, что, хотя конфокальный микроскоп является мощным инструментом визуализации, он не является спектрофлуориметром, и полученные спектры флуоресценции могут быть не совсем точными. Как показано на рисунках 4 и 5, все десять флуорофоров успешно проникли в клетки и продемонстрировали хороший или превосходный контраст на конфокальных микрофотографиях.
|
(a) |
|
(f) |
|
|
(b) |
|
(g) |
|
|
(c) |
|
(h) |
|
|
(d) |
|
(i) |
|
|
(e) |
|
(j) |
|
(a) 1a, (b) 1b, (c) 1c, (d) 1d, (e) 1e, (f) 2a, (g) 2b, (h) 2c, (i) 2d и (e) 2e (10 мкМ) в фосфатно-солевом буфере (PBS) в течение 0,5 ч при 37°C с возбуждением при 405 нм. Масштабная линейка: 20 мкм.
|
(a) |
|
|
(b) |
|
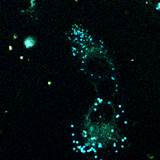
Рисунок 5. Конфокальные флуоресцентные изображения клеток линии RD, инкубированных с флуорофорами
(a) 1d и (b) 1b, в лямбда-режиме при возбуждении лазерами 405, 458 и 488 нм, соответственно.
Все протестированные флуоресцентные зонды, включая соединения 1a-e и 2a-e, демонстрировали флуоресценцию в сине-зеленом диапазоне 406-481 нм. Эти соединения накапливались в липидных каплях и не проникали в ядро клетки (рис. 4 и 5). Кроме того, большинство соединений, в частности 1b, 1d, 1e и 2c-e, также были обнаружены в эндоплазматическом ретикулуме. Производные пиридина 9d и 9e также были обнаружены в митохондриях. Примечательно, что наиболее селективными и многообещающими флуорофорами были идентифицированы 1a,c и 2a,b. Рисунок 2 иллюстрирует, что производные пиридина 1a,c-e проявили яркую флуоресценцию. Напротив, среди производных пиримидина наиболее значимую флуоресценцию продемонстрировали соединения 2a,b,d. Важно отметить, что максимумы испускания для соединений 1b и 2e, которые показали самую яркую флуоресценцию, выходят за пределы диапазона обнаружения конфокального микроскопа. Другим интересным фактом, наблюдаемым в этом эксперименте, является изменение длины волны флуоресценции в зависимости от длины волны возбуждения (эффект эмиссии, зависящий от возбуждения) и его проявление в различных клеточных компартментах. В частности, для соединений 1c и 1d при увеличении максимумов возбуждения от 405 до 488 нм происходит красное смещение максимумов флуоресценции от 475 до 525 нм (рисунок 3). Известно, что это явление объясняется сложными процессами затухания в вязких липидных средах [5]. Таким образом, вновь синтезированные флуоресцентные зонды на основе CF3-замещенного пиридина и пиримидина биологически доступны и могут легко проникать в живые клетки, накапливаясь в липидных каплях. Мы считаем, что производные пиридина и пиримидина имеют большой потенциал в качестве универсальных каркасов для разработки флуоресцентных зондов для биовизуализации. Финансовая поддержка